

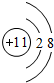 ,故答案为:
,故答案为: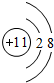 ;
;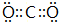 ,故答案为:
,故答案为: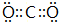 ;
;| 2mol×78g/mol |
| 7.8g |


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
| A、用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的 |
| B、福尔马林是一种良好的杀菌剂,能用来消毒饮用水 |
| C、医疗上常用体积分数为70%~75%的酒精作消毒剂 |
| D、为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭.“亮菌甲素”的结构简式如图,它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题:
2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭.“亮菌甲素”的结构简式如图,它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO,次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代.请回答:
氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO,次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 在利用CaCO3与盐酸反应制取二氧化碳的反应中,反应中生成二氧化碳的体积与反应时间的关系如图所示,两个实验所用的盐酸浓度相同,其中一个实验用是石灰石块,另一实验用是石灰石粉末,则从图中可以看出:
在利用CaCO3与盐酸反应制取二氧化碳的反应中,反应中生成二氧化碳的体积与反应时间的关系如图所示,两个实验所用的盐酸浓度相同,其中一个实验用是石灰石块,另一实验用是石灰石粉末,则从图中可以看出:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18g H2O中含有的质子数为10NA |
| B、在25℃,101kPa时,22.4L氢气中含有NA个氢原子 |
| C、46g NO2和N2O4混合气体中含有原子总数为2NA |
| D、1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com