
| (1)实验步骤 | 有关问题 |
| ①计算所需Na2SO4的质量 | 需要称量Na2SO4的质量为2.8g |
| ②称量Na2SO4固体 | 称量需要用到的主要仪器是:托盘天平 |
| ③将Na2SO4加入100mL烧杯中,并加入适量水 | 用玻璃棒搅拌至完全溶解,冷却至室温 |
| ④将烧杯中溶液转移至仪器A中(已检查不漏水) | 仪器A是100mL容量瓶; |
| ⑤洗涤烧杯,转移,定容 | |
| ⑥摇匀、装瓶、贴上标签 |
分析 (1)①依据m=CVM计算需要溶质的质量;
②依据配制溶液的体积选择合适的容量瓶;
(2)依据稀释过程中溶质的物质的量不变计算稀释后硫酸钠的物质的量浓度,硫酸钠溶液C(Na+)=2(Na2SO4);
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)硫酸根与钡离子能生成难溶于水和难溶于酸的沉淀,据此分析解答.
解答 解:(1)①配制100 mL 0.20 mol•L-1Na2SO4溶液,需要溶质的质量m=0.20mol/L×0.1L×142g/mol≈3.0g;
②配制100 mL 0.20 mol•L-1Na2SO4溶液,应选择100mL容量瓶;
故答案为:3.0 ②100mL容量瓶;
(2)设稀释后硫酸钠的物质的量浓度为C,则依据稀释过程中溶质的物质的量不变得:0.20 mol•L-1×10mL=100mL×C,解得C=0.02mol/L,C(Na+)=2(Na2SO4)=0.04mol/L;
故答案为:0.04mol/L;
(3)A.没有将洗涤液转移到容量瓶中,导致溶质的物质的量偏小,溶液浓度偏低,故不选;
B.定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故不选;
C.转移前没有将使用的容量瓶烘干,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故选;
D.定容摇匀后,发现凹液面低于刻度线,又用胶头滴管加蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏低,故不选;
故选:C;
(4)硫酸根与钡离子能生成难溶于水和难溶于酸的沉淀,注意排除碳酸根离子、亚硫酸根离子、银离子的干扰,所以正确的操作方法为:取少量待测液,滴加稀盐酸,若无明显现象,再滴加氯化钡溶液,产生白色沉淀;
故答案为:取少量待测液,滴加稀盐酸,若无明显现象,再滴加氯化钡溶液,产生白色沉淀.
点评 本题考查了一定物质的量浓度溶液的配制,硫酸根离子的检验,明确配制原理和操作步骤是解题关键,注意离子检验实验设计的严密性,题目难度不大.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
标准状况下两个容积相等的贮气瓶,一个装有O2,另一个装有CH4,两瓶气体具有相同的是
A.原子总数 B.质量  C.分子数 D.密度
C.分子数 D.密度
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4═H22++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | Ba(OH)2═Ba2++2(OH)- | D. | Na3PO4═3Na++PO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
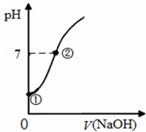 常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在次氯酸的电离平衡 | |
| B. | ②点所示溶液中:c(Na+)═c(Cl-)+c(ClO-) | |
| C. | I-能在②所示溶液中存在 | |
| D. | ①到②水的电离程度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
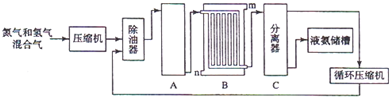
 H2+CO,CH4+H2O
H2+CO,CH4+H2O 3H2+CO;
3H2+CO;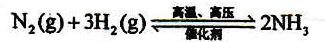 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H2SO4 | D. | 热稳定性H2O>H2Se>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com