
| A. | 仅②③④⑤⑥⑧ | B. | 仅③⑤⑥⑧ | C. | 仅①②④⑦ | D. | 除①外 |
分析 ①铝具有延展性,可用于软包装;
②在加热条件下,FeO缓慢转变成Fe2O3;
③合金是由两种或两种以上的金属与金属(或非金属)经一定方法所合成的具有金属特性的物质;
④合成纤维是有机非金属材料;
⑤硅属于半导体材料,高纯度的硅广泛用于制作计算机芯片;
⑥自来水中含有氯离子;
⑦电解精炼铜,粗铜做阳极,精铜做阴极;
⑧在金属元素与非金属元素的分界线附近的元素既有金属性又有非金属性;
解答 解:①铝用于软包装是利用了铝的延展性,故①错误;
②在加热条件下,FeO缓慢转变成Fe2O3,不能迅速转变,故②错误;
③合金是由两种或两种以上的金属与金属(或非金属)经一定方法所合成的具有金属特性的物质,所以合金材料中一定有金属,也可能含有非金属元素,故③正确;
④合成纤维是有机非金属材料,光导纤维是新型无机非金属材料,故④错误;
⑤硅位于金属元素和非金属元素分界线处,有金属和非金属的性质,所以硅属于半导体材料,高纯度的硅广泛用于制作计算机芯片,故⑤正确;
⑥自来水中含有氯离子,配制AgNO3溶液时发生的离子反应:Ag++Cl-═AgCl↓,生成白色沉淀,所以不能用自来水直接配制AgNO3溶液,故⑥正确;
⑦粗铜精炼时,与电源正极相连的是粗铜,纯铜为阴极,故⑦错误;
⑧因在金属元素与非金属元素的分界线附近的元素既有金属性又有非金属性,则可以制备半导体材料,故⑧正确;
故选B.
点评 本题考查元素化合物的性质与用途,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,题目贴近高考,难度中等.


科目:高中化学 来源: 题型:解答题
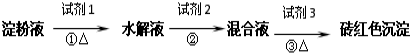
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| B. | 绿色化学的核心是利用化学原理治理环境污染 | |
| C. | 将煤气化或液化,获得清洁燃料 | |
| D. | 向高空排放金属冶炼产生的粉尘 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
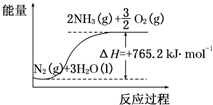 一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
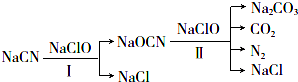
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
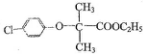 )和某聚碳酸酯工程塑料(
)和某聚碳酸酯工程塑料(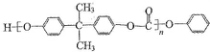 )的原料之-.
)的原料之-.
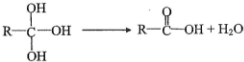
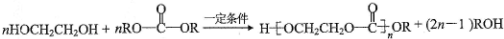
 .
. .
.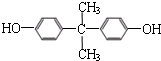 .
.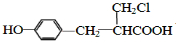 、
、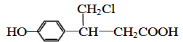 (或
(或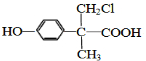 、
、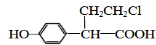 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
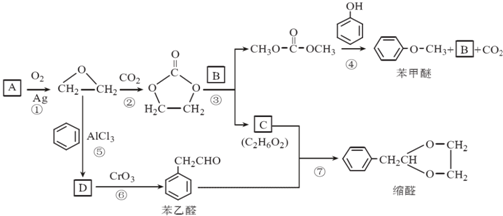
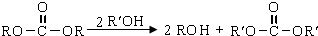
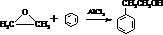 .
.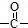 结构的苯乙醛的所有同分异构体的结构简式:
结构的苯乙醛的所有同分异构体的结构简式: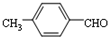 、
、 .
.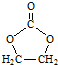 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备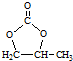 的合成路线(注明必要的反应条件)
的合成路线(注明必要的反应条件)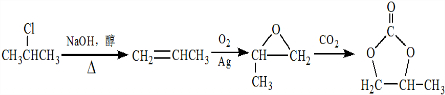 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
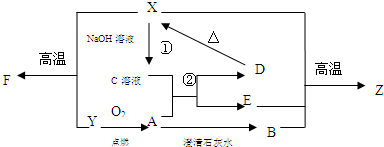
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com