
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、NO2的混合气体,这些气体与1.68LO2(标准状况下)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗溶液NaOH的体积是( )
A.60mLB.45mLC.30mLD.15mL
【答案】A
【解析】
向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,由电荷守恒可知,Cu提供电子物质的量等于氢氧化铜中氢氧根的物质的量,生成NO2、NO的混合气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,整个过程,由电子转移守恒,可知Cu提供电子等于氧气获得的电子,据此计算n(NaOH),进而计算消耗氢氧化钠溶液体积。
生成NO2、NO的混合气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,整个过程,由电子转移守恒,可知Cu提供电子等于氧气获得的电子,即Cu提供电子为:![]() ×4=0.3mol,然后根据1molCu失去2mol电子可知,铜的物质的量为0.15mol;向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,故所需的n(NaOH)=0.15mol×2=0.3mol,故消耗氢氧化钠溶液体积为
×4=0.3mol,然后根据1molCu失去2mol电子可知,铜的物质的量为0.15mol;向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,故所需的n(NaOH)=0.15mol×2=0.3mol,故消耗氢氧化钠溶液体积为![]() =0.06L=60mL,
=0.06L=60mL,
故选:A。


科目:高中化学 来源: 题型:
【题目】电解100mL含c(H+)=0.3mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
A. 0.10mol/LAg+B. 0.20mol/LZn2+C. 0.20mol/LCu2+D. 0.20mol/LPb2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电致变色玻璃以其优异的性能将成为市场的新宠。如图所示为五层膜的玻璃电致变色系统,其工作原理是:在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是

A. 当B外接电源负极时,膜由无色变为蓝色
B. 当B外接电源负极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3
C. 当A接电源的负极时,此时Li+得到电子被还原
D. 当A接电源正极时,膜的透射率降低,可以有效阻挡阳光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
Ⅰ.A是石油裂解气的主要成分,A的产量通常是衡量一个国家石油化工水平的标准。
Ⅱ.2CH3CHO+O2→2CH3COOH。
现以A为主要原料合成乙酸乙酯,其合成路线如图所示:

请回答下列问题。
(1)写出A的结构简式:___。
(2)B物质的名称是___。
(3)E___(填“能或不能”)使酸性高锰酸钾溶液褪色
(4)写出下列反应方程式及反应类型:
②化学方程式__,反应类型___。
④化学方程式__,反应类型___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)用系统命名法命名下列物质或者根据名称写出对应的结构简式
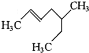 _____________
_____________
CH3CH(CH3)CH2CH(CH3)CH(CH3)CH3 ____________
3,4,4-三甲基-1-戊炔_________
(2)指出下列物质中的官能团

甲________ 乙_______ 丙__________
(3)C4H8Cl2的同分异构体有________种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃 A 是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平, A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:
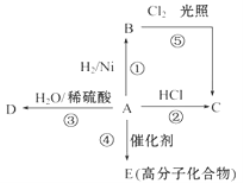
(1)物质D有特殊香味,生活中常用于饮料、燃料、消毒,D的名称为________。
(2)写出②、④两步反应的化学方程式,并注明反应类型:
②______________________,反应类型__________。
④______________________,反应类型_________。
(3)除去B中混有的少量杂质A,所用的试剂为______________。
(4)图中由A制备C的最好途径是通过反应_______(填写“②”或“①⑤”):理由是:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子二次电池因钠资源丰富、成本低、能量转换效率高等诸多优势,有望取代锂离子电池。最近,山东大学徐立强教授课题组研究钠离子二次电池取得新进展,电池反应如下:4NaxFeIIFeIII(CN)6+xNi3S2![]() 4FeIIFeIII(CN)6+3xNi+2xNa2S。下列说法正确的是
4FeIIFeIII(CN)6+3xNi+2xNa2S。下列说法正确的是

A.充电时,Na+被还原为金属钠
B.充电时,阴极反应式:xNa++FeIIFeIII(CN)6xe![]() NaxFeIIFeIII(CN)6
NaxFeIIFeIII(CN)6
C.放电时,NaxFeIIFeIII(CN)6为正极
D.放电时,Na+移向Ni3S2/Ni电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、硫及其化合物用途非常广泛。回答下列问题:
(1)基态S原子价层电子的轨道表达式为________,基态Na原子电子占据最高能级的电子云轮廓图为________形。
(2)乙炔钠广泛用于有机合成,乙炔钠中存在________(填序号)。乙炔钠的熔沸点比S8高,原因是________。
A.金属键 B.σ键 C.π键 D.氢键
(3)NaN3是用于汽车安全气囊的产气药,N3—的空间构型为________,N3—中心原子的杂化方式是____________________。
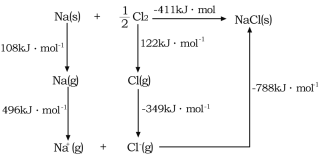
(4)![]() 的晶格能可通过图示中的born—Haber循环计算得到,Na原子的电子电离能为________kJ·mol-1,Cl-Cl的键能为_______kJ·mol-1,Cl的电子亲和能为_______kJ·mol-1,NaCl的晶格能为________kJ·mol-1。
的晶格能可通过图示中的born—Haber循环计算得到,Na原子的电子电离能为________kJ·mol-1,Cl-Cl的键能为_______kJ·mol-1,Cl的电子亲和能为_______kJ·mol-1,NaCl的晶格能为________kJ·mol-1。
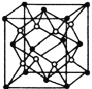
(5)已知![]() 的晶胞结构如图所示,晶体密度为1.86g·cm-3。设NA为阿伏加德罗常数的数值,则晶胞参数a=________
的晶胞结构如图所示,晶体密度为1.86g·cm-3。设NA为阿伏加德罗常数的数值,则晶胞参数a=________![]() (列出计算式)。
(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切联系。下列物质用途不正确的是( )
A.Fe2(SO4)3具有氧化性,可对饮用水杀菌消毒
B.Fe2O3为红色粉末,可用于制备红色涂料
C.Cu2O为红色粉末,可用于制备深色玻璃
D.CuSO4和熟石灰可配制农药﹣波尔多液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com