
【题目】往一体积不变的密闭容器中充入H2和I2,发生反应H2(g) + I2(g)![]() 2HI(g);
2HI(g);![]() ,当达到平衡后,t0 时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是( )
,当达到平衡后,t0 时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是( )
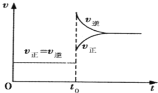
A.t0 时减小体积或升高体系温度
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度减小
D.容器内气体颜色变深,平均相对分子质量不变
【答案】D
【解析】
t0时改变反应的某一条件,正逆反应速率都增大,且逆反应速率大于正反应速率,则平衡向逆反应方向移动,该反应前后气体计量数之和相等,则只能是通过升高温度来实现。
A. 通过以上分析知,t0时改变的条件是升高温度,减少体积压强增大,平衡不移动,故A错误;
B. t0时改变反应的某一条件瞬间,正逆反应速率不相等,则平衡发生移动,因为容器的体积不变、混合气体的质量不变,则密度不变,故B错误;
C.平衡向逆反应方向移动,H2转化率减小,HI平衡浓度变小,故C错误;
D. 平衡向逆反应方向移动,碘的物质的量增大,则容器内气体颜色变深,混合气体的物质的量和质量都不变,所以平均相对分子质量不变,故D正确;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】进行一氯取代后,只能生成四种沸点不同的有机物,则该烷烃是( )
A.(CH3)2CHCH2CH2CH3B.(CH3CH2)2CHCH3
C.(CH3)2CHCH(CH3)2D.(CH3)3CCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌碘液流电池具有高电容量、对环境友好、不易燃等优点,可作为汽车的动力电源。该电池采用无毒ZnI2水溶液作电解质溶液,放电时将电解液储罐中的电解质溶液泵入电池,其装置如右图所示。下列说法不正确的是

A.M是阳离子交换膜
B.充电时,多孔石墨接外电源的正极
C.充电时,储罐中的电解液导电性不断增强
D.放电时,每消耗1molI3-,有1 molZn2+生成
查看答案和解析>>
科目:高中化学 来源: 题型:
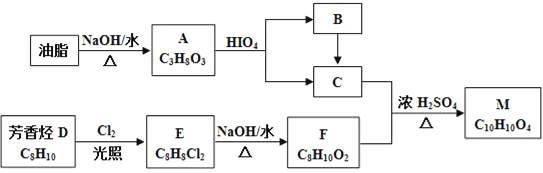
【题目】化合物M是一种香料,可采用油脂与芳香烃(含苯环的烃)为主要原料,按下列路线合成:
已知:①RX![]() ROH
ROH
②E分子中只有两种不同化学环境的H原子
③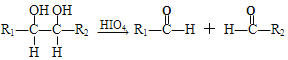
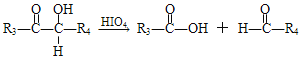
(R1、R2、R3与R4可能是氢、烃基或其他基团)
(1)A中官能团的名称是___,D→E的反应类型为___。
(2)E的结构简式为___。
(3)C+F→M的化学方程式____。
(4)下列化合物中属于F的同分异构体的是____。
a.![]()
b.![]()
c.![]()
d.CH2=CH﹣CH=CH﹣CH=CH﹣CH2COOH
(5)写出从Br﹣CH2CH2﹣Br→HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知CO2+3H2![]() CH3OH+H2O,在120℃时22gCO2发生上述反应,其反应过程的能量变化如图所示(单位为kJ·mol-1)。
CH3OH+H2O,在120℃时22gCO2发生上述反应,其反应过程的能量变化如图所示(单位为kJ·mol-1)。
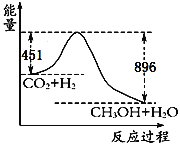
①该反应的热化学方程式为____________________。
②该反应平衡常数K的表达式为_______________________。
③在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2反应,测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到达到化学平衡,v(H2)=______mol/(L·min),下列措施中能使![]() 增大的有__________(填字母)。
增大的有__________(填字母)。
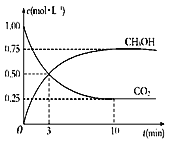
A.升高温度 B.加入催化剂 C.将H2O(g)从体系中分离
D.再充入3 mol H2 E.充入He(g),使体系总压强增大
(2)工业上常利用“隔膜电解法”处理高浓度乙醛废水。其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O=CH3CH2OH+CH3COOH。实验室按右图所示装置来模拟乙醛废水的处理(以一定浓度的乙醛和Na2SO4溶液为电解质溶液)。
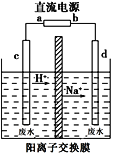
①若以甲醇碱性燃料电池为直流电源,则燃料电池中b极应通入____(填化学式)。
②电解池阳极区的电极反应式为_______________________________。
③在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入乙醛含量为3g/L的废水1 m3,可得到乙醇________kg(计算结果保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的A、B、C、D、E、F、G均为有机物(有些物质未写出)

据上图回答问题:
(1)A的结构简式_______,D的名称是__________。
(2)反应①③④的反应类型分别为_____________、____________和__________。
(3)除去F中杂质C、D时,最后要用分液的方法进行混和物的分离,F产物从分液漏斗的_______ (填“上口倒出”或“下口放出”)。
(4)写出反应②的反应方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:A(g)+B(g)![]() C(s)+D(g) △H<0,正、逆反应速率变化如图所示(υ代表反应速率,t代表时间),则t1时改变平衡的一个条件是
C(s)+D(g) △H<0,正、逆反应速率变化如图所示(υ代表反应速率,t代表时间),则t1时改变平衡的一个条件是
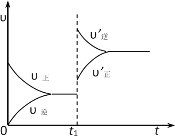
A.加入了正催化剂
B.加大了体系的压强
C.增加了体系的温度
D.加大了反应物的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:aX(g)+bY(g)![]() cZ(g),达到平衡时测得X气体的浓度为3mol/L,在恒温下将该容器体积扩大一倍,再次达到平衡时,测得X气体的浓度为1.4mol/L,则下列叙述不正确的是
cZ(g),达到平衡时测得X气体的浓度为3mol/L,在恒温下将该容器体积扩大一倍,再次达到平衡时,测得X气体的浓度为1.4mol/L,则下列叙述不正确的是
A.a+b<cB.平衡向生成Z的方向移动
C.Z的体积分数降低D.Y的转化率升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生可逆反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.80℃时,测得某时刻Ni(CO)4(g)、CO(g)浓度均为0.5 mol·L-1,则此时v(正)<v(逆)
C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
D.恒温恒容下,向容器中再充入少量的Ni(CO)4(g),达到新平衡时CO的百分含量将增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com