
短周期X、Y、Z、W四种元素在元素周期表中位置如图所示。有关表述正确的是( )
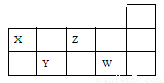
A. X、Y、W的最高价氧化物对应水化物均属强酸
B. Y的氢化物能与Y的最高价氧化物对应水化物反应
C. 原子半径从大到小依次为X>Z>Y>W
D. Z的氢化物的沸点低于W的氢化物
科目:高中化学 来源:2016届云南省高三下第七次月考理综化学试卷(解析版) 题型:选择题
短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等。则下列说法正确的是
A. B与A只能组成BA3化合物
B. C、D、E形成的化合物与稀硫酸可能发生氧化还原反应
C. A、B、C形成的化合物一定不能发生水解
D. E的氧化物一定有强的氧化性
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:填空题
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)基态硅原子的电子排布式:_______________。
(2)有一类组成最简单的有机硅化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似。硅烷中硅采取____杂化方式,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是_______________。
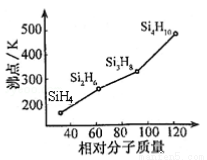
(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为_______。 (用元素符号表示)
(4)气态SeO3分子的立体构型为_________,与SeO3互为等电子体的一种离子为____________(填化学式)。
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为_________;若该晶体的晶胞棱长为a pm,则该合金密度为______g/cm 3。(列出计算式,不要求计算结果,阿伏伽德罗常数的值为NA)
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:选择题
下列描述中,正确的是( )
A.由 CH3CH2OH(l)+3O2(g) =2CO2 (g)+3H2O(g) ΔH=-1366.8 kJ·mol-1 ,可知乙醇的标准燃烧热为1366.8 kJ·mol-1
B.已知:C(金刚石,s)=C(石墨,s) ΔH<0,则金刚石比石墨稳定
C.已知:N2(g)+O2(g)=2NO(g) ΔH=+180 kJ·mol-1
2CO(g)+O2(g)=2CO2 (g) Δ H=-566 kJ·mol-1则 2CO(g)+2NO(g)===N2 (g)+2CO2(g) ΔH=-746 kJ·mol-1
D.OH-(aq)+H+(aq)===H2O(l) ΔH=-57.3 kJ·mol-1 故1 molHNO3与1mol NH3•H2O 完全反应,放出的热量一定为57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下冲刺模拟理综化学C卷(解析版) 题型:简答题
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)海带中富含碘,请简述检验碘的实验方案_____________________;
(2)已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436KJ、299KJ的能量,则1molI2(g)分子中化学键断裂时需吸收的能量为_________kJ;
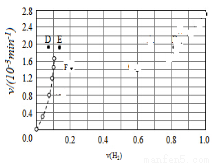
(3)Bodensteins研究了下列反应:2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
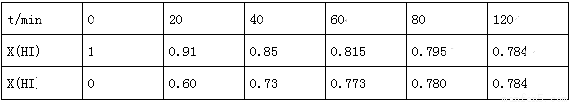
①根据上述实验结果,该反应的平衡常数K的计算式为:______________;(不用求出结果)
②其他条件不变,向平衡后体系中再加入少量HI,则平衡向_______(填“正”或“逆”)反应方向移动,达到平衡后x(HI)_______(填“增大”、“减小”或“不变”)。
③上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为_______(以K和K正表示);若k正=0.0027min-1,在t=40min时,v正=________min-1.
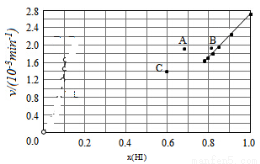
④由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为__________(填字母)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高二6月月考化学试卷(解析版) 题型:实验题
为了预防碘缺乏症,国家规定每千克食盐中应含有40~50 mg碘酸钾。碘酸钾晶体具有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂反应生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等更强的氧化剂氧化为更高价的碘的含氧酸盐。工业生产碘酸钾的流程如图所示。
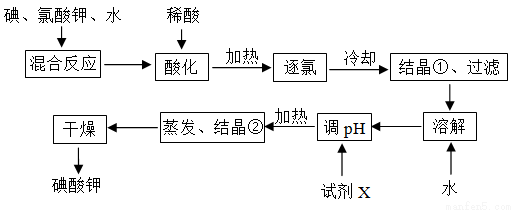
(1)碘在周期表中的位置为__________________;
(2)碘、氯酸钾、水混合反应时,若两种还原产物所得电子的数目相同,请配平该反应的化学方程式:____I2+____KClO3+____H2O=____KH(IO3)2+____KCl+____Cl2↑;
(3)混合反应后,用稀酸酸化的作用是___________________________,在稀盐酸和稀硝酸中不能选用的酸是_________,理由是__________________________________;
(4)试剂X的化学式为__________,写出用试剂X调pH的化学方程式__________________;
(5)如果省略“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应混合物的pH,对生产碘酸钾有什么影响?________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高二6月月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.强酸性溶液:Mg2+、K+、SO42-、NO3-
B.使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3-
C.0.1 mol·L–1 AgNO3溶液:H+、K+、SO42-、I-
D.0.1 mol·L–l NaAlO2溶液:H+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳二中高一6月月考化学试卷(解析版) 题型:选择题
优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极是聚2-乙烯吡啶和I2的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为:2Li+P2VP· nI2=P2VP·(n-1)I2+2LiI,则下列说法正确的
A.该电池的电势低,使用寿命比较短
B.电池工作时,碘离子移向P2VP一极
C.聚2-乙烯吡啶的复合物与有机物性质相似,因此不会导电
D .正极的反应为:P2VP·nI2+2Li++2e-=P2VP·(n-1)I2+2LiI
.正极的反应为:P2VP·nI2+2Li++2e-=P2VP·(n-1)I2+2LiI
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁师大附中高一下学期6月月考化学试卷(解析版) 题型:填空题
在一个容积固定为2L的密闭容器中,发生反应aA(g)+bB(g) pC(g)△H=?。反应情况记录如下表:
pC(g)△H=?。反应情况记录如下表:
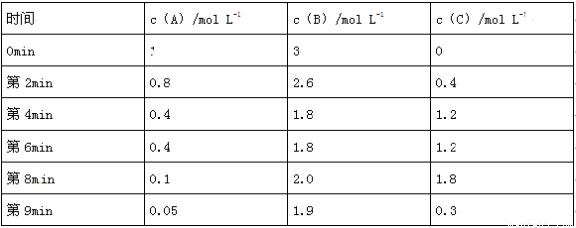
请仔细分析,根据表中数据回答下列问题:
(1)a= ____________,b= _______________, p=_____________。
(2)第2min到第4min内A的平均反应速率v(A)= _________ mol•L-1•min-1。
(3)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8min时分别改变了某一反应条件,则改变的条件分别可能是:
①第2min:___________ ______或_____________;
②第6min ________________________;
③第8min _______________________ ;
(4)若从开始到第4min建立平衡时反应放出的热量为235.92kJ,则该反应的△H=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com