
【题目】某铝土矿中主要含有Al2O3、Al(OH)3还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如图所示:
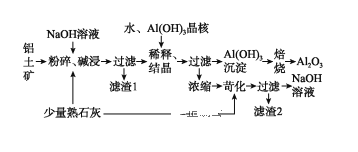
请回答下列问题:
(1)粉碎后的铝土矿碱浸时应在较高温度下进行,其目的是____________________。滤渣1的主要成分为________________。
(2)Al2O3与NaOH溶液反应的离子方程式为____________________________________。
(3)加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的_________气体的方法来代替。(已知:通入该气体后,其产物之一可用来做发酵粉)。
(4)焙烧过程中发生的化学方程式为_________________________________。
(5)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化(即与少量熟石灰反应)反应除去,写出苛化反应的化学方程式:_________________________________________________。
(6)该生产流程能实现____________________(填化学式)的循环利用。
【答案】加快反应速率 Fe2O3 Al2O3+2OH-=2AlO2-+H2O CO2 2Al(OH)3![]() Al2O3+3H2O Ca(OH)2 +Na2CO3=CaCO3↓+2NaOH NaOH
Al2O3+3H2O Ca(OH)2 +Na2CO3=CaCO3↓+2NaOH NaOH
【解析】
铝土矿用强碱溶液进行转化成偏铝酸盐,加入Al(OH)3晶核促进Al(OH)3的析出,加水稀释也是促进偏铝酸根离子的水解,最后滤出氢氧化铝,然后焙烧氢氧化铝得到三氧化二铝。
(1)温度升高会加快反应速率;铝土矿中的Fe2O3不溶于NaOH溶液,Al(OH)3和Al2O3都和强碱溶液反应生成Al2O3;
(2)Al2O3与NaOH溶液反应生成NaAlO2和水;
(3)NaHCO3可用来做发酵粉,在偏铝酸钠溶液中通入过量二氧化碳气体可生成Al(OH)3和NaHCO3;
(4)焙烧过程中为Al(OH)3受热分解生成Al2O3和水;
(5) 浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,杂质是碳酸钠,碳酸钠与氢氧化钙反应生成苛性钠,从而除去碳酸根离子;
(6) 后续反应中生成氢氧化钠,而前阶段是用氢氧化钠溶解铝土矿。
铝土矿用强碱溶液进行转化成偏铝酸盐,加入Al(OH)3晶核促进Al(OH)3的析出,加水稀释也是促进偏铝酸根离子的水解,最后滤出氢氧化铝,然后焙烧氢氧化铝得到三氧化二铝;
(1)粉碎后的铝土矿碱浸时应在较高温度下进行,其目的是加快反应速率;铝土矿中的Fe2O3不溶于NaOH溶液,Al(OH)3和Al2O3都和强碱溶液反应生成Al2O3,则滤渣1的主要成分为Fe2O3;
(2) Al2O3与NaOH溶液反应生成NaAlO2和水,则发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O;
(3) NaHCO3可用来做发酵粉,在偏铝酸钠溶液中通入过量二氧化碳气体可生成Al(OH)3和NaHCO3,则上述“稀释、结晶”工艺,也可用通入足量的CO2气体的方法来代替;
(4) 焙烧过程中为Al(OH)3受热分解生成Al2O3和水,发生的化学方程式为2Al(OH)3![]() Al2O3+3H2O;
Al2O3+3H2O;
(5) 浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,杂质是碳酸钠,碳酸钠与氢氧化钙反应生成苛性钠,从而除去碳酸根离子,方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(6) 后续反应中生成氢氧化钠,而前阶段是用氢氧化钠溶解铝土矿,该生产流程能实现的循环利用是NaOH。


科目:高中化学 来源: 题型:
【题目】两个单环共用一个碳原子的多环化合物称为螺环化合物,共用的碳原子称为螺原子。螺[5,5]十一烷的结构为![]() ,下列关于该化合物的说法错误的是( )
,下列关于该化合物的说法错误的是( )
A.一溴代物有三种
B.与十一碳烯互为同分异构体
C.分子中所有碳原子不可能在同一平面
D.1mo1该化合物完全燃烧需要16mo1O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是红黄色有毒气体,有刺激性气味,沸点为11℃,极易溶于水但不与水反应,遇热水缓慢水解成次氯酸、氯气和氧气,见光也易分解,因此其溶液置于冷暗处相对稳定。某校合作学习小组的同学欲制备二氧化氯水溶液并检验其性质。
Ⅰ.二氧化氯水溶液制备。
向圆底烧瓶中先加入10gKClO3固体和9gH2C2O4·2H2O(草酸),然后再加入5mL稀硫酸,用磁力搅拌器搅拌(如下图);将烧瓶放在热水浴中,保持水浴温度在60~80℃,至B中广口瓶内溶液呈深红黄色时停止加热。
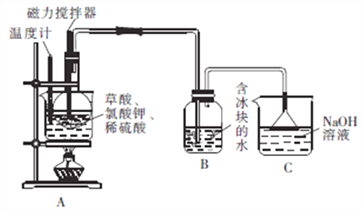
回答下列问题:
(1)装置A用水浴加热的优点是_________________;装置A中水浴温度不宜低于60℃也不宜高于80℃,其原因是______________________。
(2)装置A中反应生成ClO2及KHSO4等产物的化学方程式为_________________。
(3)装置B的水中需放入冰块的目的是_________________,装置C的作用是_______________
Ⅱ.设计实验验证ClO2的氧化性。
(4)取适量ClO2水溶液加入H2S溶液中,振荡,得无色溶液。欲检验H2S的氧化产物,还需要用到的试剂是_______________________。
(5)证明ClO2的氧化性比Fe3+强的方案是______________________。
(6)将少量ClO2水溶液滴入盛有MnSO4溶液的试管中,振荡,有黑色沉淀生成,则该反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4![]() K2MnO4+MnO2+O2↑,将0.1moKMnO4固体加热一段时间后,收集到amolO2;向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中(注:KMnO4和K2MnO4以及MnO2都能与浓盐酸反应并生成Mn2+)。
K2MnO4+MnO2+O2↑,将0.1moKMnO4固体加热一段时间后,收集到amolO2;向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中(注:KMnO4和K2MnO4以及MnO2都能与浓盐酸反应并生成Mn2+)。
(1)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中的还原产物是_____(填化学式),反应中若产生0.3mol的气体则有________mol的电子转移。
(2)a+b的最大值为________,a+b最小值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
B.Cl2是一种有毒气体,不可用于自来水的杀菌消毒
C.SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物
D.Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂等的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2与Cl2的氧化性相近。在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。(已知:装置C的作用是吸收Cl2)
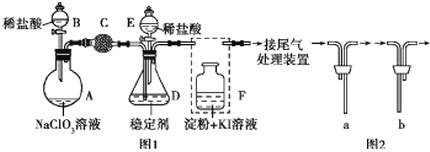
(1)仪器B的名称是________。安装F中导管时,应选用图2中的_________________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O.为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜_______________(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,NaClO2中Cl的化合价为______。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为__________。
(5)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应离子方程式为___________________。(已知:在酸性条件下SO32-被ClO3-氧化为SO42-)
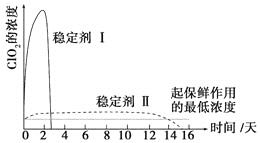
(6)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是__________,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将 2mol NO2 装入 5 L 带活塞的密闭容器中,当反应 2NO2(g) N2O4(g)ΔH=-60 kJ/mol 达到平衡时,恢复到原来的温度,测得此过程中体系向外界共释放了 40 kJ 的热量。 下列说法正确的是( )
A.温度升高,平衡常数 K 增大
B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C.上述反应达到平衡时,NO2的转化率是 40%
D.若起始时向容器中充入 1.0 mol N2O4,保持温度不变,达到平衡时共吸收 20 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列“解释或结论”与“实验操作及现象”不相符的一组是
序号 | 实验操作及现象 | 解释或结论 |
A | 浓硫酸滴到纸张上,纸变黑 | 浓硫酸有脱水性 |
B | 向紫色石蕊溶液中加入氯水,溶液先变红,随后褪色 | 氯水中含有酸性物质和 漂白性物质 |
C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体 | 该溶液中一定有CO32- |
D | 向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体 | 该溶液中一定含有NH |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com