
科目:高中化学 来源: 题型:
15.8gKMnO4与100mL12mol/L过量浓盐酸充分反应,化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl+5Cl2↑+8H2O,通过计算回答:
(1)产生的Cl2在标准状况下的体积为多少?
(2)有多少摩尔HCl被氧化?
(3)在反应后的溶液中加足量的AgNO3溶液可生成多少克沉淀?
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表中短周期元素部分,表中字母分别代表一种元素:
| a | b | ||||||
| d | e | f | |||||
| c | g | h |
⑴上述 元素(填元素名称)可以形成硬度最大的单质。
⑵“神舟”六号飞船内需要有一种化合物来吸收宇航员呼出的 CO2,并释放出O2,你认为该物质应该是由上表中的 和 元素(填元素名称)组成的。飞船中需要制造一种适合宇航员生存的人工生态环境,应该在氧气中充入一种气体用于稀释氧气,该气体分子是 。(填化学式)
⑶表中元素g的氢化物稳定性比元素e的氢化物的稳定性 (填“强”或“弱”)。
⑷将潮湿的由h元素构成的单质通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是 。(填数字序号)
|
⑸写出h元素构成的单质与水反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
1L某溶液中存在下列离子:Ba2+、Fe2+、Al3+、Fe3+、Mg2+ 、HCO3-、CO32-、Cl-、NO3-、SO42- 中的五种,浓度均为0.1mol/L,若向原溶液中加入足量的盐酸,有气体生成。经分析知:反应后的溶液中的阴离子的种类没有变化。则下列说法正确的是
A.原溶液中一定含有HCO3-或CO32-
B.原溶液中可能含有Ba2+、Al3+
C.若向原溶液中加入过量的稀硫酸和KSCN溶液,溶液不显血红色
D.若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体的质量为12g

查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质,按化合物、单质、混合物顺序排列的是( )
A 烧碱、液态氧、碘酒 B 生石灰、白磷、熟石灰
C 干冰、铁、氯化氢 D 空气、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,正确的是( )
A 铁与盐酸反应:2Fe + 6H+ = 2Fe3+ + 3H2 ↑
B 氯气与氯化铁溶液反应:2 FeCl2 + Cl2 =2 FeCl3
C 氯化铁溶液与铁反应:Fe3+ + Fe =2 Fe2+
D 氯化铁溶液与氢氧化钠溶液反应:Fe3+ + 3 OH- = Fe( OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
制备食用碘盐(KIO3)原理之一为: ,下列说法正确的是
,下列说法正确的是
A.向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀
B.反应过程中I2置换出Cl2,由此可推断非金属性I> CI
C.KClO3和KIO3均属于离子化合物,都只含有离子键
D.制备KIO3的反应中氯元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合硫酸铁又称聚铁,化学式为 ,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
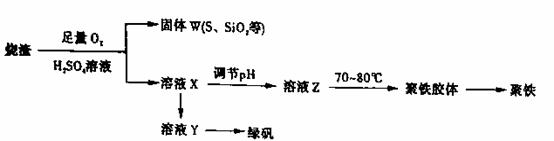
(1)验证固体W焙烧后产生的气体含有SO2 的方法是_____。
(2)实验室制备、收集干燥的SO2 ,所需仪器如下。装置A产生SO2 ,按气流方向连接各仪器接口,顺序为a f装置D的作用是_____,装置E中NaOH溶液的作用是______。

(3)制备绿矾时,向溶液X中加入过量_____,充分反应后,经_______操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为______。若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com