


| 68 |
| 12 |
 ,则X为环戊烯,B为
,则X为环戊烯,B为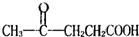 ,C为CH3CH(OH)CH2CH2COOH,D为
,C为CH3CH(OH)CH2CH2COOH,D为 ,C发生缩聚反应生成高分子化合物E,F能与溴发生加成反应,故C发生消去反应生成F,且F含有一个甲基,则F为CH3CH=CHCH2COOH,H为CH3CHBrCHBrCH2COOH,F发生加聚反应生成高分子化合物G,据此解答.
,C发生缩聚反应生成高分子化合物E,F能与溴发生加成反应,故C发生消去反应生成F,且F含有一个甲基,则F为CH3CH=CHCH2COOH,H为CH3CHBrCHBrCH2COOH,F发生加聚反应生成高分子化合物G,据此解答.| 68 |
| 12 |
 ,则X为环戊烯,B为
,则X为环戊烯,B为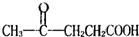 ,C为CH3CH(OH)CH2CH2COOH,D为
,C为CH3CH(OH)CH2CH2COOH,D为 ,C发生缩聚反应生成高分子化合物E,F能与溴发生加成反应,故C发生消去反应生成F,且F含有一个甲基,则F为CH3CH=CHCH2COOH,H为CH3CHBrCHBrCH2COOH,F发生加聚反应生成高分子化合物G,
,C发生缩聚反应生成高分子化合物E,F能与溴发生加成反应,故C发生消去反应生成F,且F含有一个甲基,则F为CH3CH=CHCH2COOH,H为CH3CHBrCHBrCH2COOH,F发生加聚反应生成高分子化合物G, ;F为CH3CH=CHCH2COOH,分子中含有5种化学环境不同的H原子,故其核磁共振氢谱共有5个峰;故答案为:
;F为CH3CH=CHCH2COOH,分子中含有5种化学环境不同的H原子,故其核磁共振氢谱共有5个峰;故答案为: ;5;
;5;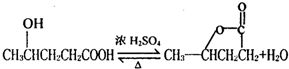 ,故答案为:
,故答案为: ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
| ||
| ||
| △ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lg c(M),pCO32-=-lg c(CO32-).下列说法不正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lg c(M),pCO32-=-lg c(CO32-).下列说法不正确的是( )| A、MgCO3、CaCO3、MnCO3 的Ksp依次减小 |
| B、a 点可表示MnCO3 的饱和溶液,且c(Mn2+)=c(CO32-) |
| C、b 点可表示的CaCO3不饱和溶液,且c(Ca2+)<c(CO32-) |
| D、c 点可表示MgCO3 的不饱和溶液,且c(Mg2+)<c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
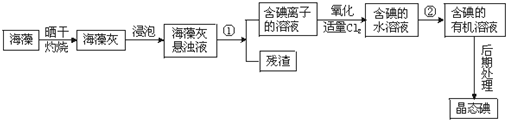
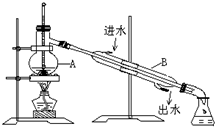
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、当电路中有1.204×1022个电子转移时,乙烧杯中溶液的C(H+)约为0.1mol?L-1 |
| B、电池工作时,盐桥中的K+移向甲烧杯 |
| C、电池工作时,外电路的电子方向是从a到b |
| D、乙池中的氧化产物为SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com