
分析 (1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算,化学反应中,反应物的总能量大于生成物的总能量,反应放热,反之吸热,以此计算反应热并判断吸热还是放热,反应热与化学计量数成正比,结合热化学方程式的书写规则书写该反应的热化学方程式;
(2)根据(1)热化学方程式计算;
(3)根据(1)热化学方程式,反应热与化学计量数呈正比进行计算;
(4)根据(1)N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,则完全分解1mol NH3吸收$\frac{1}{2}$×92kJ=46kJ的热量;
解答 解:(1)拆1mol H-H键,1mol N-H键,1mol N三N键分别需要吸收的能量436kJ,391kJ,946kJ,在反应N2+3H2?2NH3中,断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,
生成2mol NH3,共形成6molN-H键,放出的能量为:6×391kJ=2346kJ,
吸收的能量少,放出的能量多,该反应为放热反应,
放出的热量为:2346kJ-2254kJ=92kJ,1mol N2(g)和3mol H2(g)完全转化为NH3(g)生成2mol NH3放出热量为92KJ,
所以该反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1;
(2)由N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,则1mol N2完全生成NH3放出92KJ的热量,故答案为:放出;92;
(3)由N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,则1mol H2气生成NH3需放出$\frac{1}{3}$×92kJ≈31kJ,故答案为:放出;31;
(4)根据(1)N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,则完全分解1mol NH3吸收$\frac{1}{2}$×92kJ=46kJ的热量,故答案为:吸收;46;
点评 本题主要考查了反应热的计算、热化学方程式的书写,注意把握从键能的角度计算反应热的方法,注意热化学方程式:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
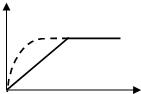 如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 加催化剂 | B. | 增大体积 | C. | 升高温度 | D. | 加大X的投入量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间/min | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 烧杯和药品的总质量/g | 210.0 | 206.8 | 205.9 | 205.7 | 205.6 | 205.6 | 205.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若两元素原子序数相差8,则周期数一定相差1 | |
| B. | 两种简单离子不可能相差3个电子层 | |
| C. | 同族的两元素之间不可能形成化合物 | |
| D. | 最外层电子数相同的微粒一定位于同一族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温条件下,在空气中铝不容易被腐蚀 | |
| B. | 镀锌铁片比镀锡铁片更耐腐蚀 | |
| C. | 镀银的铁制品,镀层部分受损后,露出的铁表面易被腐蚀 | |
| D. | 远洋海轮的尾部装上一定数量的锌板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气分子内每个氢原子都达到8电稳定结构 | |
| B. | 氢气分子的能量比氢原子的能量低 | |
| C. | 1molH2离解成2molH 要放出437.6kJ 热量 | |
| D. | 氢原子的还原性比氢分子的还原性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每摩尔Si晶体中,含有2摩尔Si-Si共价键 | |
| B. | 在CO2晶体中,与每个CO2分子周围紧邻的有12个CO2分子 | |
| C. | 在CsCl晶体中,与每个Cs+周围紧邻的有8个Cl-,而与每个Cs+等距离紧邻的也有8个Cs+ | |
| D. | 在金刚石晶体中,最小碳原子环含有6个碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com