
| A. | 原子序数:A>B>C>D | B. | 单质熔点:D>B,A>C | ||
| C. | 原子半径:C>B>D>A | D. | 简单离子半径:C>A>D>B |
分析 A、B、C、D为四种短周期元素,已知A、C同主族,A的气态氢化物比C的气态氢化物稳定,则A在C的上一周期,A为第二周期元素,C为第三周期元素,B的阳离子比C的阴离子少一个电子层,则B为第三周期元素,B、D同周期,B的阳离子比D的阳离子氧化性强,则金属性D>B,然后结合元素周期律来解答.
解答 解:A、B、C、D为四种短周期元素,已知A、C同主族,A的气态氢化物比C的气态氢化物稳定,则A在C的上一周期,A为第二周期元素,C为第三周期元素,B的阳离子比C的阴离子少一个电子层,则B为第三周期元素,B、D同周期,B的阳离子比D的阳离子氧化性强,则金属性D>B,
A.由同周期随原子序数的增加,金属性减弱、非金属性增强可知,原子序数:C>B>D>C,故A错误;
B.金属的电荷越大,半径越小,熔点高,可知单质熔点:D>B,而同主族非金属单质的熔点从上到下增大,可知单质熔点:A<C,故B错误;
C.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:D>B>C>A,故C错误;
D.电子层越多,离子半径越大,具有相同结构的离子中原子序数大的离子半径小,则简单离子半径:C>A>D>B,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握非金属性、金属性比较及元素的位置为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
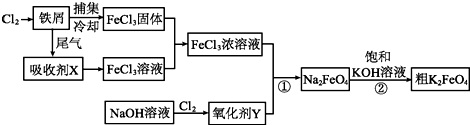
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃料的脱硫脱氮、SO2的回收利用和NOX的催化转化都是减少酸雨产生的措施 | |
| B. | 用FeCl2溶液与铜反应制作印刷电路板 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 碳酸钠治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可利用油脂水解制备甘油 | |
| B. | 食用油反复加热会产生芳香族化合物等有害物质 | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 糖、油脂、蛋白质都能水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中有3molH2C2O4被还原,转移6mol电子 | |
| B. | KClO3发生了还原反应 | |
| C. | KClO3的还原性强于CO2的还原性 | |
| D. | ClO2作水处理剂时,利用了其强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 58.5 g氯化钠中约含有6.02×1023个氯化钠分子 | |
| B. | 常温常压下,2.24LC2H4中含有共用电子对的数目为0.6NA | |
| C. | 0.1molNa2O2与足量的水反应,转移电子数为0.2NA | |
| D. | 200mL 0.5 mol•L-1的Na2CO3溶液中CO32-离子数目小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com