
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)=C(金刚石);△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ | |
| D. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=-285.8 kJ•mol-1 |
分析 A.硫蒸气具有能量较高,则前者放出热量较多;
B.物质具有能量越高,其稳定性越弱,结合该反应为放热反应分析;
C.浓硫酸溶于水放热,导致放出热量增大;
D.2g氢气的物质的量为1mol,则2mol放出的热量为285.8×2 kJ.
解答 解:A.气态硫的能量高于固态硫的,所以等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量多,故A错误;
B.该反应为吸热反应,生成物的能量高,所以石墨比金刚石稳定,故B错误;
C.浓硫酸溶于水放热,含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ,故C正确;
D.2g氢气的物质的量为:$\frac{2g}{2g/mol}$=1mol,焓变与化学计量数成正比,该反应热的数值错误,故D错误;
故选C.
点评 本题考查了热化学方程式的书写及应用,题目难度不大,明确物质稳定性与具有能量的关系为解答关键,注意熟练掌握热化学方程式的书写原则,试题培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
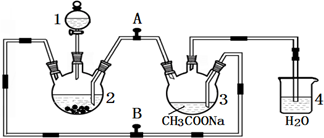 醋酸亚铬水合物
醋酸亚铬水合物查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石能源物质内部蕴涵着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 | |
| C. | 吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值 | |
| D. | 物质的化学能可以在一定条件下转化为热能.电能为人类所利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
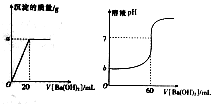 室温下,某同学为测量硫酸和盐酸混合溶液中溶质的浓度进行如下实验:取混合酸20mL放入锥形瓶中,逐滴滴人0.05mol•L-1的Ba(OH)2溶液,实验记录如下:(1g3=0.5)
室温下,某同学为测量硫酸和盐酸混合溶液中溶质的浓度进行如下实验:取混合酸20mL放入锥形瓶中,逐滴滴人0.05mol•L-1的Ba(OH)2溶液,实验记录如下:(1g3=0.5)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正>ν逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
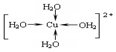 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
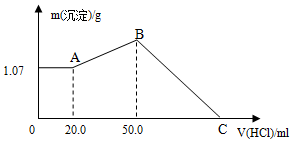 把NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:
把NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
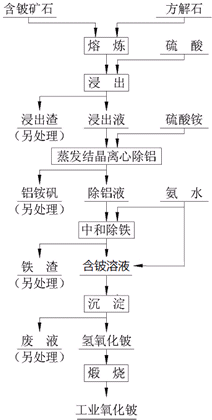 硫酸法是现代氧化铍或氢氧化铍生产中广泛应用的方法之一,其原理是利用预焙烧破坏铍矿物(绿柱石-3BeO•Al2O3•6SiO2及少量FeO等)的结构与晶型,再采用硫酸酸解含铍矿物,使铍、铝、铁等酸溶性金属进入溶液相,与硅等脉石矿物初步分离,然后将含铍溶液进行净化、除杂,最终得到合格的氧化铍( 或氢氧化铍) 产品,其工艺流程如图.
硫酸法是现代氧化铍或氢氧化铍生产中广泛应用的方法之一,其原理是利用预焙烧破坏铍矿物(绿柱石-3BeO•Al2O3•6SiO2及少量FeO等)的结构与晶型,再采用硫酸酸解含铍矿物,使铍、铝、铁等酸溶性金属进入溶液相,与硅等脉石矿物初步分离,然后将含铍溶液进行净化、除杂,最终得到合格的氧化铍( 或氢氧化铍) 产品,其工艺流程如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com