
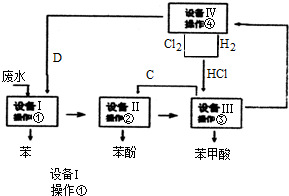
分析 由流程可知,设备Ⅰ中含有苯、苯酚、苯甲酸的工业废水,加入试剂D为氢氧化钠溶液,其中苯酚和苯甲酸发生反应生成苯酚钠、苯甲酸钠,通过操作①分液得到苯,溶液进入设备Ⅱ,设备Ⅱ加入试剂C是二氧化碳气体,二氧化碳和苯酚钠溶液反应可得到苯酚,发生C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,操作②分液得到苯酚,溶液进入设备Ⅲ中加入HCl反应生成苯甲酸和氯化钠,操作③过滤得到苯甲酸沉淀和溶液氯化钠,溶液氯化钠进入Ⅳ通过操作④电解得到氯气、氢气和氢氧化钠溶液,氢氧化钠溶液、氯气和氢气反应生成的氯化氢分别进入设备Ⅰ和设备Ⅲ循环利用,
(1)操作③为分离苯甲酸和溶液,苯甲酸溶解性小形成固体,通过过滤分离;
(2)操作①是分液,据此选择仪器;
(3)上述分析可知C为二氧化碳,D为氢氧化钠溶液;
(4)设备Ⅳ中是电解氯化钠溶液;
(5)设备Ⅱ中发生的化学反应是二氧化碳通入苯酚钠溶液生成苯酚和碳酸氢钠;
(6)设备Ⅳ中是电解氯化钠溶液生成氯气、氢气和氢氧化钠.
解答 解:由流程可知,设备Ⅰ中含有苯、苯酚、苯甲酸的工业废水,加入试剂D为氢氧化钠溶液,其中苯酚和苯甲酸发生反应生成苯酚钠、苯甲酸钠,通过操作①分液得到苯,溶液进入设备Ⅱ,设备Ⅱ加入试剂C是二氧化碳气体,二氧化碳和苯酚钠溶液反应可得到苯酚,发生C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,操作②分液得到苯酚,溶液进入在设备Ⅲ中加入HCl反应生成苯甲酸和氯化钠,操作③过滤得到苯甲酸沉淀和溶液氯化钠,溶液氯化钠进入Ⅳ通过操作④电解得到氯气、氢气和氢氧化钠溶液,氢氧化钠溶液、氯气和氢气反应生成的氯化氢分别进入设备Ⅰ和设备Ⅲ循环利用,
(1)操作③为分离苯甲酸和氯化钠溶液,苯甲酸溶解性小形成固体,通过过滤操作分离,操作③的名称为过滤,
故答案为:过滤;
(2)操作①是分液,所需要用到的玻璃仪器有烧杯和分液漏斗,
故答案为:烧杯、分液漏斗;
(3)上述分析可知C为二氧化碳,D为氢氧化钠溶液,
故答案为:CO2、NaOH;
(4)设备Ⅳ中是电解氯化钠溶液,设备Ⅲ中加入HCl反应生成苯甲酸和氯化钠,操作③过滤得到苯甲酸沉淀和溶液氯化钠,溶液氯化钠进入Ⅳ通过操作④电解得到氯气、氢气和氢氧化钠溶液,设备Ⅲ进入设备Ⅳ中物质的化学式为NaCl,
故答案为:NaCl;
(5)设备Ⅱ中发生的化学反应是二氧化碳通入苯酚钠溶液生成苯酚和碳酸氢钠,反应的化学方程式为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,
故答案为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3;
(6)设备Ⅳ中是电解氯化钠溶液生成氯气、氢气和氢氧化钠,反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
点评 本题考查了物质分离提纯方法,物质性质、实验操作、物质分离的实验过程判断,主要是试剂选择和实验基本操作的理解应用,题目难度中等.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.02 mol•L-1醋酸与0.02 mol•L-1NaOH等体积混合后的溶液中加少量的CH3COONa固体则$\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$增大 | |
| B. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | lmol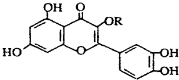 与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol 与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol | |
| D. | 红外光谱分析不能区分乙醇和乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由A和B两种元素形成的化合物BA5中含共价键 | |
| B. | 含C或E元素的某些物质具有杀菌消毒的作用,其原理相同 | |
| C. | 原子半径:D>C>B,离子半径B>C>D | |
| D. | 由A、C、E三种元素形成的某种化合物AEC,其结构式A-E-C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg和Al都可以用电解法冶炼得到 | |
| B. | Mg和Fe在一定条件下与水反应都生成H2 和对应的碱 | |
| C. | Fe和Cu常温下放入浓硝酸中发生的现象相同 | |
| D. | Na2O和Na2O2与CO2反应产物也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 为证明反应的发生,可取甲中溶液加入酸性高锰酸钾溶液 | |
| B. | 反应开始时,乙中电极反应为2I--2e-=I2 | |
| C. | 电流计读数为零时,反应达到化学平衡状态 | |
| D. | 反应开始时,甲中石墨电极上Fe3+被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO燃烧 | B. | H2SO4与NaOH反应 | ||
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体反应 | D. | 生石灰与水作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com