
【题目】室温下向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 的一元酸HA,溶液的pH的变化曲线如图所示, 不正确的是
的一元酸HA,溶液的pH的变化曲线如图所示, 不正确的是
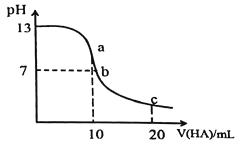
A.a点时,溶液中存在![]()
B.b点时,![]()
C.c点时,溶液中存在![]()
D.水的电离程度:![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.已知2C(s)+2O2(g)=2CO2(g)△H=a kJmol-1,2C(s)+O2(g)=2CO(g)△H=b kJmol-1,则a>b
B.石墨和金刚石完全燃烧的化学方程式均可表示为“C+O2![]() CO2”,故相同条件下,12g的石墨和金刚石充分燃烧放出的热量相等
CO2”,故相同条件下,12g的石墨和金刚石充分燃烧放出的热量相等
C.一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3,放热19.3 kJ,据此实验事实可知:该条件下,每生成1mol NH3,放热19.3 kJ
D.4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g)是放热反应,Cl-Cl键和O=O键的键能分别243kJmol-1和498kkJmol-1,则可推算出H-O键的键能比H-Cl键的键能大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】去甲肾上腺素是一种重要的神经递质,以石油裂解产物A和邻甲氧基苯酚为原料,经过中间体藜芦醛,合成去甲肾上腺素的路线如下所示。
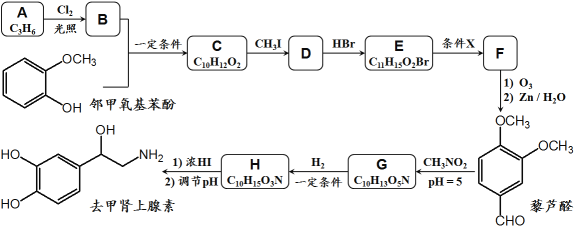
已知:①
![]()
![]()

②![]()
![]()
![]() +
+![]()
③![]() +
+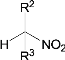
![]()
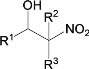
④D和F互为同分异构体。
回答下列问题:
(1)C → D的反应类型为__________,G → H的反应类型为__________;
(2)条件X为__________,E在条件X作用下发生变化的官能团名称为__________;
(3)关于上述合成,下列说法正确的是__________;(填序号)
a.1mol邻甲氧基苯酚能与3mol Br2发生取代反应
b.合成路线中CH3I和浓HI的作用是保护酚羟基不被O3氧化
c.藜芦醛分子中至少有14个原子共平面
d.1mol去甲肾上腺素熔化后至多可消耗3mol Na和2mol NaOH
(4)B + 邻甲氧基苯酚 → C的化学方程式为_______________________________;
(5)藜芦醛的同系物Y相对分子质量比藜芦醛大14,写出Y满足下列条件所有同分异构体的结构简式:
①能发生银镜反应;②1mol该有机物能消耗2mol NaOH(aq);③核磁共振氢谱有4组峰
__________________________________________________________;
(6)试设计以间苯二酚(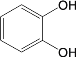 )为原料,制备聚酯
)为原料,制备聚酯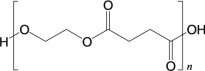 的合成路线。(无机试剂任选,仅可使用间苯二酚作有机原料)___________
的合成路线。(无机试剂任选,仅可使用间苯二酚作有机原料)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法不正确的是(NA为阿伏加德罗常数的值)
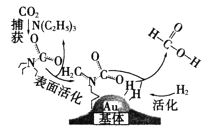
A.10.1gN(C2H5)3中所含的共价键数目为2.1NA
B.标准状况下,22.4LCO2中所含的电子数目为16NA
C.在捕获过程中,二氧化碳分子中的共价键完全断裂
D.100g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
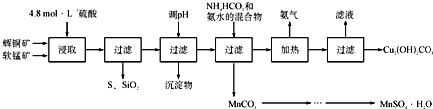
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0molL-1计算):
开始沉淀的pH | 沉淀完全的pH | |
Fe 3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有____________________(任写一点);
(2)调节浸出液pH的范围为____________,其目的是_______________________;
(3)本工艺中可循环使用的物质是____________________(写化学式).
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成_________________的结果;
(5)碳酸锰在一定条件下可得硫酸锰溶液,试根据如下曲线图示,现由硫酸锰溶液制备MnSO4·H2O的实验方案为____________________。
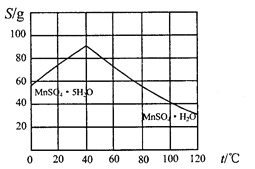
(6)用标准BaCl2溶液测定样品中MnSO4H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有_________________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.25mol·L-1的NaOH溶液,分别滴定同浓度的三种稀酸溶液,滴定的曲线如图所示,下列判断不正确的是
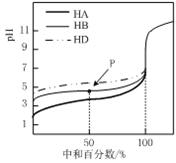
A. 同浓度的稀酸中:c(A-)>c(B-)>c(D-)
B. 滴定至P点时,溶液中:c(B-)>c(HB)
C. pH=7时,三种溶液中:c(A-)>c(B-)>c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB) +c(HD)═c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生活中或实验室中的常用物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池.请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑
(2)实验用品:电极(__、__)、稀硫酸、__、__耳机(或电流计).
(3)①按如图所示装置连接好实验仪器,这时可以听见耳机发出“嚓嚓……”的声音。其原因是在原电池中化学能转化为__,在耳机中__又转化为声波这种能量。
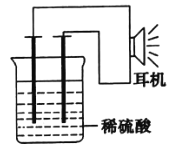
②在该原电池内中,Fe在___极发生了___反应,H+在___极发生了___反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,人类可以从海水中提取各种化工产品。下图是某工厂对海水综合利用的示意图:
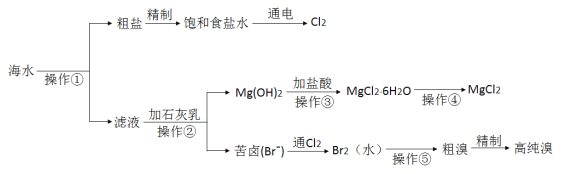
完成下列填空:
(1)写出电解饱和食盐水的化学方程式_____________,检验氯气生成的方法是_________。
(2)液氯储存在钢瓶中,钢瓶上应贴的标签为_________________(选填编号)。
a.自燃品 b.爆炸品 c.有毒品 d.易燃品
(3)Mg(OH)2加入盐酸充分反应后,操作③ 是从MgCl2溶液中获得MgCl26H2O晶体,此处需要进行的实验操作依次为____________________________。
(4)操作④是加热MgCl26H2O获得MgCl2,简述其实验操作及其原因________________。
(5)操作⑤是向溶液中鼓入__________,即可将溴单质从溶液中分离出来,此方法的成功应用是基于溴单质有____________性。
(6)粗溴的精制过程是先将粗溴用SO2水溶液吸收,将其转变成Br,再通Cl2,最后蒸馏得到高纯溴。用SO2水溶液吸收Br2的吸收率可达95%,有关反应的离子方程式为_________。由此反应可知,除环境保护外,在工业生产中应解决的主要问题是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】央视焦点访谈节目曾报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构如下图所示,下列说法正确的是( )
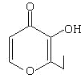
A.该有机物的分子式为C7H6O3
B.1mol该有机物最多能与2molH2发生加成反应
C.该有机物的一种芳香族同分异构体能发生银镜反应
D.该有机物能发生取代、加成、氧化和还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com