
【题目】下列指定反应的离子方程式正确的是
A.往碘化亚铁中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
B.氯气与水反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C.硝酸银溶液中加入过量氨水:Ag+ +NH3·H2O=AgOH↓+NH4+
D.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为
A.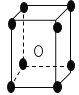 B.
B.
C.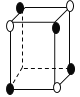 D.
D.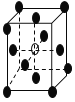
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是

A. 图中五点Kw的关系:B>C>A=D=E
B. 若从A点到E点,可采用温度不变,向水中加入适量的NH4Cl固体
C. 若从A点到D点,可采用温度不变,向水中加入少量的酸
D. 当处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里,从废旧钴酸锂离子电池的正极材料(在铝箔上涂覆活性物质LiCoO2)中,回收钴、锂的操作流程如下图所示:

回答下列问题。
(1)拆解废旧电池获取正极材料前,先将其浸入NaCl溶液中,使电池短路而放电,此时溶液温度升高,该过程中能量的主要转化方式为____。
(2)“碱浸”过程中产生的气体是____;“过滤”所得滤液用盐酸处理可得到氢氧化铝,反应的化学方程式为____。
(3)“酸浸”时主要反应的离子方程式为____;若硫酸、Na2S2O3溶液用一定浓度的盐酸替代,也可以达到“酸浸”的目的,但会产生____(填化学式)污染环境。
(4)“沉钴”时,调pH所用的试剂是____;“沉钴”后溶液中c(Co2+)=____。(已知:Ksp[Co(OH)2]=1.09×l0-15)
(5)在空气中加热Co(OH)2,使其转化为钴的氧化物。加热过程中,固体质量与温度的关系如左下图所示。290~500℃,发生反应的化学方程式为____。
(6)根据右下图判断,“沉锂”中获得Li2CO3固体的操作主要包括____、____、洗涤、干燥等步骤。
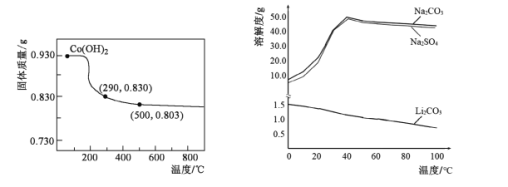
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物他莫昔芬( Tamoxifen)的一种合成路线如下图所示:
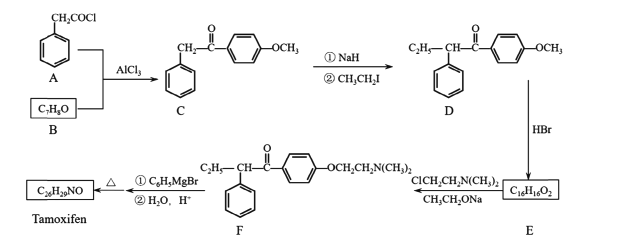
已知: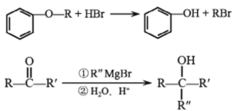
回答下列问题。
(I)A+B-C的反应类型为____;C中官能团有醚键、____(填名称)。
(2)CH3CH2I的名称为____。
(3)反应D-E的化学方程式为____。
(4)Tamoxifen的结构简式为____。
(5)X是C的同分异构体。X在酸性条件下水解,生成2种核磁共振氢谱都显示4组峰的芳香族化合物,其中一种遇FeCl3溶液显紫色。X的结构简式为_______(写2种)。
(6)设计用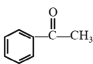 和CH3I为原料(无机试剂任选)制备
和CH3I为原料(无机试剂任选)制备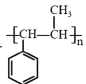 的合成路线:____。
的合成路线:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,将一块铁溶于800mL1mol/L的稀硫酸溶液中,反应完全,求:
(1)所溶解铁的质量为多少____?
(2)产生的H2的体积为多少____?
(3)完全反应后,硫酸亚铁的浓度是多少____?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较,不能用元素周期律解释的是
A.酸性:![]()
B.热稳定性:Na2 CO3![]() NaHCO3
NaHCO3
C.与水反应的速率:Na![]() Mg
Mg
D.非金属性:Cl![]() Br
Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数值,下列叙述中正确的
A.0.4 mol NH3与0.6 mol O2在催化剂的作用下充分反应,得到NO的分子数为0.4NA
B.C60和石墨的混合物共1.8 g,含碳原子数目为0.15NA
C.1 L 0.1 mol/LNH4Al(SO4)2溶液中阳离子总数小于0.2NA
D.5.6 g铁在足量的O2中燃烧,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 某有机物完全燃烧,得到8.8g二氧化碳和5.4g水。此有机物的蒸气对氢气的相对密度为23,该有机物与金属钠反应放出氢气。其分子式为___________,结构简式__________。
某有机物完全燃烧,得到8.8g二氧化碳和5.4g水。此有机物的蒸气对氢气的相对密度为23,该有机物与金属钠反应放出氢气。其分子式为___________,结构简式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com