
【题目】下列说法不正确的是
A. 大米富含淀粉
B. 加碘食盐含有碘酸钾(KIO3)
C. 人体必需的微量元素就是维生素
D. 人体必需的微量元素不都是金属元素
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图所示是气体性质实验的常用装置,下列有关实验现象的说法不正确的是( )

A.若水槽中是水,试管中是NO2,可看到液面上升,若充入一定量的O2可使液体充满整个试管
B.若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升、试管中黄绿色褪去
C.若水槽中是水并滴有几滴紫色石蕊,试管中是SO2,可看到液面上升并变为无色
D.若水槽中是水并滴有几滴酚酞,试管中是NH3,可看到液面上升并呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子在指定溶液中能大量共存的是( )
A.酸性溶液中:Cl-、SO![]() 、Fe3+、Mg2+
、Fe3+、Mg2+
B.使酚酞变红的溶液中:Na+、CO32-、Cl-、Al3+
C.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO![]()
D.1.0 mol·L-1的CuSO4溶液:H+、Ba2+、AlO2-、NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验,所得实验现象和实验结论正确的是( )
实验 | 现象 | 实验结论 | |
A | 将SO2气体通入紫色石蕊试液中 | 溶液先变红后褪色 | 二氧化硫具有酸性和漂白性 |
B | 将小苏打和硫酸应生成的气体,通入一定浓度的Na2SiO3溶液中 | 出现白色胶状沉淀 | 酸性: H2SO4﹥H2CO3﹥H2SiO3 |
C | 将光亮的镁条放入盛有NH4Cl溶液的试管中 | 有大量气泡产生 | 反应中有NH3产生 |
D |
| 试管a出现白色沉淀, 试管b出现黄色沉淀 | 溶度积:Ksp(AgCl)﹥Ksp(AgI) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌(ZnO)、氮化镓(GaN)及新型多相催化剂组成的纳米材料能利用可见光分解水,生成氢气和氧气。
(1)Zn2+基态核外电子排布式为
(2)与CNO-互为等电子体的分子、离子化学式分别为 、 (各写一种)
(3)ZnO是两性氧化物,能跟强碱溶液反应生成[Zn(OH)4]2-。不考虑空间构型,[Zn(OH)4]2-的结构可用示意图表示为 ,某种ZnO晶体的晶胞如图1所示,O2-的配位数为


图1 ZnO晶胞 图2 GaN晶胞
(4)图2是氮化镓的晶胞模型。其中镓原子的杂化方式为 杂化,N、Ga原子之间存在配位键,该配位键中提供电子对的原子是 。氮化镓为立方晶胞,晶胞边长为a pm,若氮化镓的密度为ρg·cm-3,则氮化镓晶胞边长的表达式a= pm(设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是
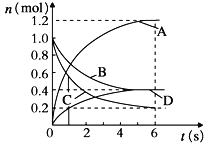
A.该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D.反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 常温常压下,8g O2含有4NA个电子
B. 1L 0.1mol·L-1的氨水中有0.1NA个NH4+
C. 标准状况下,22.4L四氯化碳含有NA个分子
D. 1molNa被完全氧化生成Na2O2,失去2NA电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋白质的性质在生活中有许多实际应用.请在下表“性质”一栏中表述的蛋白质性质填空.
实例 | 性质 |
(1)紫外线消毒 | 变性 |
(2)蛋白质遇浓硝酸变黄 | |
(3)误食了重金属离子,可以立即喝大量的牛奶来缓解毒性 | |
(4)鸡蛋清溶液中加入少量饱和的硫酸铵溶液出现沉淀 | |
(5))常用酒精清洗伤口 | |
(6)蒸煮鸡蛋食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途。
(1)真空碳热还原—氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)═2Al(l)+AlCl3(g) △H=bkJ·mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=__________kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:

①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K= 。
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.通入一定量的NO
b.通入一定量的N2
c.适当升高反应体系的温度
d.加入合适的催化剂
e.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
A.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
C.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前3Omin的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)=____ _____mol/L。NO的转化率_________(填“增大”、“减小”或“不变”)。
(3)铝电池性能优越,,Al-Ag2O电池可用作水下动力电源,其原理如图所示

请写出该电池正极反应式___________;常温下,用该化学电源和惰性电极电解300mL硫酸铜溶液(过量),消耗27mgAl,则电解后溶液的pH=___________(不考虑溶液体积的变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com