
| A. | 向以上平衡体系中加入足量浓NaOH溶液,两平衡都向右移动,Al(OH)3的质量增加 | |
| B. | 向以上平衡体系中加入足量浓盐酸,Al3+的物质的量增加 | |
| C. | 在同一溶液中,Al3+与OH-能大量共存 | |
| D. | 在同一溶液中,AlO2-与H+能大量共存 |
分析 A.加NaOH会消耗氢离子,平衡右移;
B.加浓盐酸会消耗氢氧根离子;
C.Al3+与OH-会生成Al(OH)3;
D.AlO2-与H+能生成Al(OH)3.
解答 解:A.加NaOH会消耗氢离子,平衡右移,Al(OH)3的质量减少,故A错误;
B.加浓盐酸会消耗氢氧根离子,平衡左移,Al3+的物质的量增加,故B正确;
C.Al3+与OH-会生成Al(OH)3沉淀,所以在同一溶液中,Al3+与OH-不能大量共存,故C错误;
D.AlO2-与H+能生成Al(OH)3沉淀,所以在同一溶液中,AlO2-与H+不能大量共存,故D错误.
故选B.
点评 本题考查了铝的化合物的性质、化学平衡移动原理的应用,题目难度不大,注意把握浓度对化学平衡的影响.


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:解答题
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液中加入c(填字母) | 液变成血红色 | 滤液中有Fe3+ |
| 步骤2:在滤液中加入a(填字母) | 紫红色褪去 | 滤液中有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al(OH )3胶体中加入酒精溶液能发生聚沉现象 | |
| B. | 豆浆和雾都是胶体 | |
| C. | Fe(OH )3 胶体能透过滤纸 | |
| D. | 向沸水中加入饱和的FeCl3溶液,可制备Fe(OH )3 胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青蒿素的摩尔质量为282g | |
| B. | 青蒿素的化学合成方法没有任何研究意义 | |
| C. | 青蒿素转化为双氢青蒿素是物理变化 | |
| D. | 用乙醚提取黄花蒿叶中的青蒿素比用水效果好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:钠>硫>氯 | |
| B. | 最高价氧化物对应的水化物的酸性:H3PO4<H2SO4<HClO4 | |
| C. | 最高正化合价:氯>硫>磷 | |
| D. | 热稳定性:碘化氢>溴化氢>氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
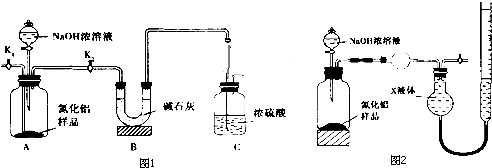

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com