
分析 (1)根据n=$\frac{m}{M}$计算物质的量之比,分子数目之比等于其物质的量之比,均由氧原子构成,氧气和臭氧的质量相等,则含有氧原子数目相等;密度之比等于物质的量之比的倒数;
(2)Na2X中含有0.08molNa+,可知Na2X为0.04mol,结合M=$\frac{m}{n}$计算.
解答 解:(1)n=$\frac{m}{M}$可知,等质量的氧气和臭氧(O3)的物质的量之比为48g/mol:32g/mol=3:2,体积之比等于物质的量之比为3:2;二者含有分子数目之比为3:2,均由氧原子构成,氧气和臭氧的质量相等,则含有氧原子数目相等,就所含原子数目之比为1:1,标准状况下的密度之比等于物质的量之比的倒数,即密度之比为2:3;
故答案为:3:2; 3:2;1:1;2:3;
(2)Na2X中含有0.08molNa+,可知Na2X为0.04mol,则Na2X的摩尔质量是$\frac{12g}{0.04mol}$=300g/mol.
故答案为:300g/mol.
点评 本题考查了物质的量的有关计算以及阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:实验题
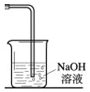 实验室常用以下方法制取氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答
实验室常用以下方法制取氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
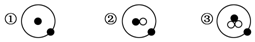
 ”表示中子.
”表示中子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com