
青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
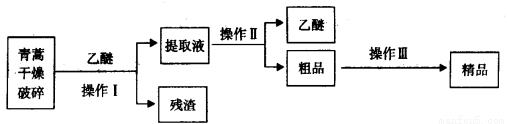
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、___________,为加速操作I的进行,最好采用________________的方法,操作Ⅱ的名称是___________________。
(3)操作Ⅲ的主要过程可能是_____________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
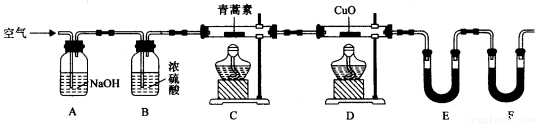
①装置E中盛放的物质是______________,装置F中盛放的物质是________________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______________。
③用合理改进后的装置进行试验,称得:

则测得青蒿素的最简式是__________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响, 其结果如下图所示:
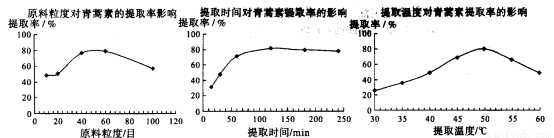
由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_______________。
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:填空题
Ⅰ充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍.
(1)求该有机物的分子式 .
(2)该有机物链状同分异构体的结构简式为: 、 、 .
(3)若有机物A在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则用键线式表示的结构简式为 .
Ⅱ 0.1mol某饱和一元醇充分燃烧,生成的产物通过碱石灰,碱石灰增重26.6g.且该醇不能进行催化氧化反应.则该醇的结构简式为 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省温州市十校联合高二下期中化学试卷(解析版) 题型:选择题
北京国家游泳馆“水立方”是在国内首次采用以钢材为支架,覆盖ETFE薄膜。ETFE是乙烯和四氟乙烯的共聚物,是一种轻质透明的新材料。关于该材料下列说法错误的是( )
A.ETFE极易分解,符合环保要求 B.ETFE韧性好,拉伸强度高
C.ETFE比玻璃轻、安全 D.ETFE是混合物,无固定的熔点
查看答案和解析>>
科目:高中化学 来源:2016届河南省原推荐高三四月高考仿真模拟理综化学试卷(解析版) 题型:推断题
【化学—选修5:有机化学基础】
有机物E(分子式C8H7ClO)在有机合成中有重要应用,它能与氯化铁发生显色反应,分子中苯环上有两种氢原子,其工业合成途径如下:
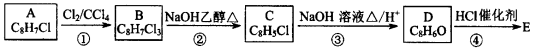
(1)A的结构简式__________________,B中含有的官能团是_________________。
(2)反应①~④中,属于加成反应的是______________________(填序号)
(3)写出步骤②反应方程式___________________,其反应类型为__________________。
(4)E分子核磁共振氢谱有5组峰,峰面积之比为1:1:1:2:2。
①则E的结构简式为_______________________;
②E的同分异构体中含有苯环且能够发生银镜反应的物质有_________种,其中核磁共振氢谱有4组峰,峰面积之比为1:2:2:2,写出其结构简式为______________________。
查看答案和解析>>
科目:高中化学 来源:2016届河南省原推荐高三四月高考仿真模拟理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,6.0gNO和2.24LO2混合,所得气体的分子数目为0.2NA
B.常温常压下,1L0.1mol·L-1的硝酸铵溶液中氮原子数目为0.2NA
C.1mol有机物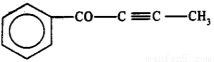 中最多有6NA个原子在一条直线上
中最多有6NA个原子在一条直线上
D.1mol甲基(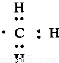 )所含的电子数为7NA
)所含的电子数为7NA
查看答案和解析>>
科目:高中化学 来源:2016届广东省佛山市高三4月二模理综化学试卷(解析版) 题型:实验题
用软锰矿(主要成分为MnO2)生产高锰酸钾产生的锰泥中,还含有18%的MnO2、3%的KOH(均为质量分数),及少量Cu、Pb的化合物等,用锰泥可回收制取MnCO3,过程如图:
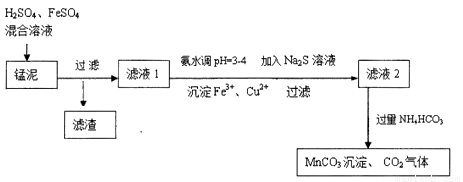
(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。通常用来酸化高锰酸钾的酸是
(2)除去滤液1中Cu2+的离子方程式是
(3)经实验证明:MnO2稍过量时,起始H2SO4、FeSO4混合溶液中c(H+)/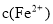 <0.7时,滤液1中能够检验出有Fe
<0.7时,滤液1中能够检验出有Fe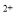 ;
;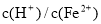 ≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②③:
≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②③:
①检验Fe2+是否氧化完全的实验操作是__________。
②生产时H2SO4、FeSO4混合溶液中c(H+)/c(Fe2+)控制在0.7~1之间,不宜过大,请从节约药品的角度分析,原因是__________。
③若c(H+)/c(Fe2+)>1,调节c(H+)/c(Fe2+)到0.7~1的最理想试剂是_(填序号)
a.NaOH溶液 B.铁粉 c.MnO。
(4)写出滤液2中加入过量NH4HCO3反应的离子方程式__________。
(5)上述过程锰回收率可达95%,若处理1740 kg的锰泥,可生产MnCO3__________kg。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省宁波市高考模拟理综化学试卷(解析版) 题型:选择题
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等,Z为非金属性最强的元素。下列说法正确的是
A、原子半径:W>Y>Z,而简单离子的半径:Z>Y>W
B、W的氯化物水溶液中通入XY3至过量,现象是先生成白色沉淀,后逐渐溶解
C、Z的非金属性强于Y,因此其最高价氧化物对应水化物的酸性强于Y
D、YX3沸点远高于YZ3的原因是YX3存在分子间氢键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高一下期中化学试卷(解析版) 题型:选择题
下列表示物质结构的化学用语或模型正确的是
A.8个中子的碳原子的符号:12C B.HF的电子式:H+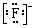
C.Cl—离子的结构示意图: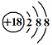 D.CH4分子的比例模型:
D.CH4分子的比例模型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com