
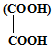
 .
.分析 烃A与溴发生取代反应生成B,B在氢氧化钠的醇溶液中加热发生消去反应生成C,C与溴水发生加成反应生成D,D在氢氧化钠的水溶液中加热发生水解反应生成E,E发生催化氧化生成F,F再发生催化氧化生成乙二酸,逆推可知,F为OHC-CHO、E为HOCH2CH2OH、D为BrCH2CH2Br、C为CH2=CH2、B为CH3CH2Br、A为CH3CH3,据此解答.
解答 解:(1)由上述分析可知,C为CH2=CH2,B→C是CH3CH2Br发生消去反应生成CH2=CH2,E发生催化氧化生成F,化学方程式是
HOCH2CH2OH+O2$→_{△}^{催化剂}$OHC-CHO+2H2O,故答案为:CH2=CH2;消去反应;HOCH2CH2OH+O2$→_{△}^{催化剂}$OHC-CHO+2H2O;
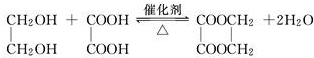
(2)由上述分析可知,E为HOCH2CH2OH,则E与乙二酸发生酯化反应生成环状化合物的化学方程式为: ,
,
故答案为: ;
;
(3)通过以上分析知,B的结构简式为:CH3CH2Br,C的结构简式为:CH2=CH2,则由B发生水解反应或C与H2O发生加成反应均生成化合物G为CH3CH2OH,
乙二酸是羧酸酸性较强,苯酚弱酸性,CH3CH2OH不能电离出氢离子,故羟基上活泼氢原子的活泼性为乙二酸>苯酚>水>G(乙醇),
故答案为:HOOCCOOH>C6H5OH>H2O>CH3CH2OH;
(4)MTBE是一种重要的汽油添加剂,它是1戊醇的同分异构体,即分子式为C5H12O;又与G的某种同分异构体互为同系物,且分子中含有4个相同的烃基;则分子中5个碳原子有四个相同的基团应为甲基,故为CH3-O-C(CH3)3,其同类别同分异构体有甲丁醚4种,乙丙醚2种,共6种,
故答案为:CH3-O-C(CH3)3;6.
点评 本题考查了有机物的推断,以乙二酸为突破口采用逆推的方法进行推断,明确有机物的结构和性质是解本题关键,注意反应条件,反应条件不同导致产物不同,为易错点.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸亚铁 | B. | 还原铁粉 | C. | 亚硫酸钠 | D. | 生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,用0.1000mol•L-1的盐酸滴定0.1000mol•L-1Na2CO3溶液25.00mL.用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是( )
常温下,用0.1000mol•L-1的盐酸滴定0.1000mol•L-1Na2CO3溶液25.00mL.用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是( )| A. | c→d发生的主要离子反应:HCO3-+H+=H2O+CO2 | |
| B. | 在b点 时,c(CO32-)>c(HCO3)->c(OH-) | |
| C. | 在d点 时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| D. | 在e点 时c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
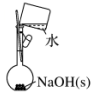
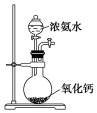
科目:高中化学 来源: 题型:选择题
| A.配制0.10 mol•L-1 NaOH溶液 | B.制备少量氨气 |
 |  |
| C.称量氢氧化钠固体质量 | D.干燥氨气 |
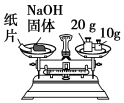 | 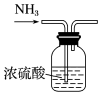 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上电解熔融的氯化钠可以制备钠 | |
| B. | 工业上用Cl2和石灰乳为原料制造漂白粉 | |
| C. | 工业上电解饱和氯化镁溶液可制取金属镁 | |
| D. | 工业上常用H2在Cl2中燃烧生成的氯化氢溶于水来制取盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com