
分析 (1)根据题目所给物质的量的多少结合热化学方程式的书写方法来回答,反应的化学方程式为:4FeS2+11O2=2Fe2O3+8SO2,标出各物质的聚集状态;在反应中4 mol FeS2的质量为m(FeS2)=4 mol×120 g•mol-1=480 g,放热Q=480 g×7.1 kJ/g=3408 kJ,标注物质聚集状态和对应反应的焓变写出;
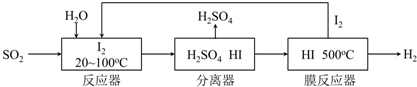
(2)根据该循环的工艺流程是用硫铁矿(FeS2)燃烧产生的SO2来制硫酸,在反应器中发生反应:SO2+I2+2H2O=2HI+H2SO4,在膜反应器中的反应为:2HI?I2+H2,将两个方程式相加得;
(3)根据平衡移动的原理来分析,将H2分离出来有利于平衡向右移动,利于I2和H2的生成;
(4)①用吸收H2后的稀土储氢合金作为电池负极材料,放电做负极失电子发生氧化反应;
②根据负极反应的特点和总电池反应来回答,负极反应物MH失去电子,生成的H+在碱性条件下生成H2O;
③根据氧气进入另一个电极阴极上是氧气发生的电子的过程.
解答 解:(1)反应的化学方程式为:4FeS2+11O2=2Fe2O3+8SO2,标出各物质的聚集状态;在反应中4 mol FeS2的质量为m(FeS2)=4 mol×120 g•mol-1=480 g,放热Q=480 g×7.1 kJ/g=3408 kJ,对应的热化学方程式为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ•mol-1,故答案为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ•mol-1;
(2)在反应器中发生反应:SO2+I2+2H2O=2HI+H2SO4,在膜反应器中的反应为:2HI?I2+H2,将两个方程式相加得:SO2+2H2O=H2SO4+H2,故答案为:SO2+2H2O=H2SO4+H2;
(3)在膜分离器中发生反应:2HI?I2+H2,将H2分离出来有利于平衡向右移动,利于I2和H2的生成,故答案为:有利于平衡向右移动,有利于碘和氢气的生成;
(4)①用吸收H2后的稀土储氢合金作为电池负极材料,放电做负极失电子发生氧化反应,MH中M化合价为0价,
故答案为:0;
②负极反应物MH失去电子,生成的H+在碱性条件下生成H2O,电解反应式为:MH-e-+OH-=H2O+M,故答案为:MH-e-+OH-=H2O+M;
③阴极上是氧气发生的电子的过程,电极反应式为:O2+4e-+2H2O=4OH- 或4MH+O2+4e-=2H2O+4M,
故答案为:O2+4e-+2H2O=4OH- 或4MH+O2+4e-=2H2O+4M.
点评 本题考查了热化学方程式书写、氧化还原反应化学方程式、化学平衡的影响因素、电解池原理的理解应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
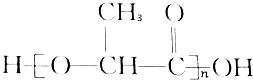 能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )| A. | 聚乳酸是一种纯净物 | B. | 聚乳酸的单体是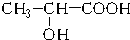 | ||
| C. | 聚乳酸是一种羧酸 | D. | 其聚合方式和乙烯相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力防治 PM2.5 的污染防治,可减少雾霾天气 | |
| B. | “84 消毒液”具有强氧化性,可作环境的消毒剂 | |
| C. | 发展低碳经济,利用太阳能、风能实现城市照明 | |
| D. | 可以用福尔马林溶液保存海鲜产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
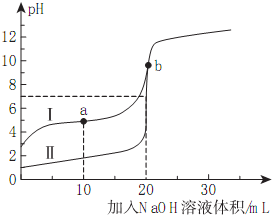 室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的HA和HB溶液,滴定曲线如图所示.下列说法错误的是( )
室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的HA和HB溶液,滴定曲线如图所示.下列说法错误的是( )| A. | 当Ⅰ代表HB,b点时体系中有:c(B-)+c(HB)=0.05mol/L | |
| B. | 滴定分析中,甲基橙不能用做滴定曲线Ⅰ中的指示剂 | |
| C. | a点时的溶液中离子浓度最大的是c(Na+) | |
| D. | 若Ⅱ代表HA的滴定曲线,则Ka(HB)≈10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| C. | 药皂中含有苯酚,能杀菌消毒,故苯酚具有强氧化性 | |
| D. | 屠呦呦获得了2015年诺贝尔奖,她用乙醚提取青蒿素的过程属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol/L的硝酸钾溶液中:Mg2+,Fe2+、Cl-、SO42- | |
| B. | 由水电离的c(H+)=1.0×10-13mol/L的溶液中:Ca2+,K+、Br-、HCO3- | |
| C. | 在pH=1的溶液中:NH4+、Na+、ClO-、Cl- | |
| D. | 无色溶液中:Al3+、Na+、S2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
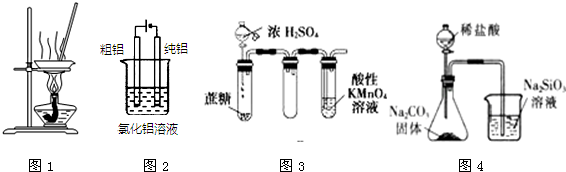
| A. | 用图1装置蒸发FeCl3溶液制备无水FeCl3 | |
| B. | 用图2装置精炼铝 | |
| C. | 用图3装置证明浓硫酸具有脱水性和强氧化性 | |
| D. | 用图4装置可比较氯、碳、硅三种元素的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 |
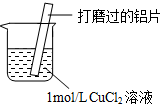 | ⅰ.红色物质附着于铝片表面 ⅱ.大量无色气体从红色物质表面逸出,放出大量的热 ⅲ.烧杯底部出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com