
【题目】下列有机物中同分异构体数目最多的是( )
A.分子式为C4H10的二氯代物
B.分子式为C3H9N的有机物,其中N原子以三个单键与其他原子相连
C.分子式为C8H10的苯的同系物的一氯代物
D.分子式为C7H16的有机物
【答案】C
【解析】
A.烷烃C4H10的二氯取代产物同分异构体为:①CHCl2CH2CH2CH3、②CH2ClCHClCH2CH3、③CH2ClCH2CHClCH3、④CH2ClCH2CH2CH2Cl、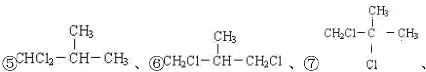 ⑧CH3CCl2CH2CH3,⑧CH3CHClCHClCH3,共有9种;
⑧CH3CCl2CH2CH3,⑧CH3CHClCHClCH3,共有9种;
B.分子式为C3H9N的有机物,其中N原子以三个单键与其他原子相连,可能的有机物的结构简式有:CH3CH2CH2(NH2)、CH3CH(NH2)CH3、CH3-NH-CH2CH3、N(CH3)3,总共有4种;
C.分子式为C8H10的苯的同系物,如果含有两个-CH3,如果两个甲基处于邻位,苯环上的一氯代物2种,侧链上的一氯代物1种;如果两个甲基处于间位,苯环上一氯代物有3种,侧链上的一氯代物1种;如果两个甲基处于对位,苯环上一氯代物有1种,侧链上的一氯代物1种;如果含有一个-CH2CH3,苯环上一氯代物有3种,侧链上的一氯代物2种,所以共有14种;
D.烷烃C7H16的同分异构体有9种;
同分异构体数目最多的是C,故选C。


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】某有机物结构简式如图,下列对该物质的叙述中正确的是

A.该有机物能发生取代反应、氧化反应和消去反应
B.1mol该有机物最多可与2molNaOH发生反应
C.该有机物可以与溴的四氯化碳溶液发生加成反应使之褪色
D.该有机物有3个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂,实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1。
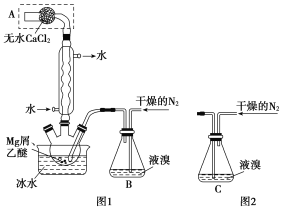
主要步骤如下:
步骤1:三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2:缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3:反应完毕后恢复至室温,过滤除去镁,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4:常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性
②MgBr2+3C2H5OC2H5→MgBr2·3C2H5OC2H5
请回答下列问题:
(1)仪器A的名称是__。实验中不能用干燥空气代替干燥N2,原因是__。
(2)如将装置B改为装置C(图2),可能会导致的后果是__。
(3)有关步骤4的说法,正确的是__。
A.可用95%的乙醇代替苯溶解粗品
B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯
D.该步骤的目的是除去乙醚和可能残留的溴
(4)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Mg2++Y4-=Mg+Y2-
①滴定前润洗滴定管的操作方法是__。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是__(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
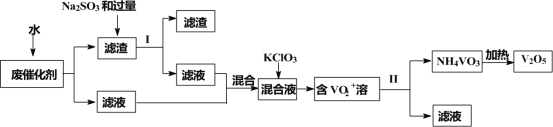
已知:①部分含钒物质常温下在水中的溶解性如表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
②VO2++2OH-![]() VO3-+H2O
VO3-+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为____________(写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为____________(填离子符号)。
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式为____________。
(4)生成VO2+的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式为____________。
(5)在第Ⅱ步中需要加入氨水,请结合化学用语,用平衡移动原理解释加入氨水的一种作用为____________。
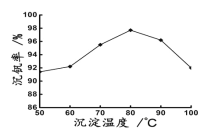
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。请结合如图解释在第Ⅱ步中温度超过80°C以后,沉钒率下降的可能原因是____________;____________(写两条)。
(7)该工艺流程中可以循环利用的物质为____________。
(8)测定产品中V2O5的纯度:
称取ag产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol·L1(NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+==VO2++Fe3++H2O)。最后用c2mol·L1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO4-被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182g·mol1)的质量分数是____________。(列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g) ![]() C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
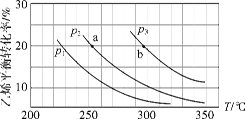
A.乙烯气相直接水合反应的H<0
B.图中压强的大小关系为:p1>p2>p3
C.图中a点对应的平衡常数K =![]()
D.达到平衡状态a、b所需要的时间:a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按以下步骤可由![]() 合成
合成![]() (部分试剂和反应条件已略去)。
(部分试剂和反应条件已略去)。
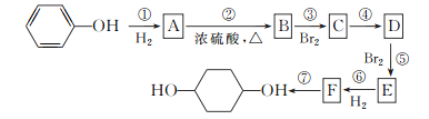
请回答下列问题:
(1)分别写出B、D的结构简式:B__,D___。
(2)反应①~⑦中属于消去反应的是__,属于加成反应的是__(填写序号)。
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到E的可能的结构简式为__。
(4)试写出C→D反应的化学方程式:__(有机物写结构简式并注明反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向密闭容器中充入一定量的NH3,发生反应2NH3(g)N2(g)+3H2(g)。达到平衡时,N2的体积分数与温度、压强的关系如图所示,下列说法正确的是
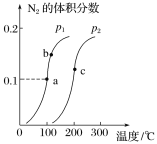
A.a点时,NH3的转化率为30%
B.达到平衡时,2v正(NH3)=3v逆(H2)
C.b、c两点对应的平衡常数:Kb<Kc
D.压强:p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
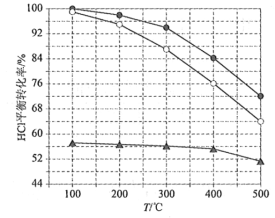
可知反应平衡常数K(300℃)____________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=____________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是____________。
(2)Deacon直接氧化法可按下列催化过程进行:CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1,CuCl(s)+
Cl2(g) ΔH1=83 kJ·mol-1,CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1,CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1,则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol-1。
Cl2(g) ΔH2=-20 kJ·mol-1,CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1,则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol-1。
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是______________。(写出2种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下: 下列说法不正确的是( )
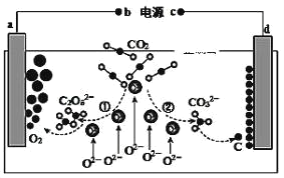
A.b 为电源的正极
B.①②中,捕获 CO2 时碳元素的化合价发生了变化
C.a 极的电极反应式为 2C2O52--4e-=4CO2 +O2
D.上述装置存在的电解总反应式为:CO2 ![]() C+O2
C+O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com