
| A. | 称量时托盘上要垫上干净的称量纸 | |
| B. | 移液时不慎有部分液体溅出,会造成所配溶液浓度偏小 | |
| C. | 定容时俯视容量瓶刻度线,会造成所配溶液浓度偏大 | |
| D. | 定容摇匀后发现液面下降,不应再加蒸馏水 |
分析 结合c=$\frac{n}{V}$及不当操作对n、V的影响分析误差,称量NaOH固体在小烧杯中,以此来解答.
解答 解:A.NaOH潮解后,可腐蚀物质,则称量时NaOH放在小烧杯中,故A错误;
B.移液时不慎有部分液体溅出,n偏小,由c=$\frac{n}{V}$可知,会造成所配溶液浓度偏小,故B正确;
C.定容时俯视容量瓶刻度线,v偏小,由c=$\frac{n}{V}$可知,会造成所配溶液浓度偏大,故C正确;
D.定容摇匀后发现液面下降,不应再加蒸馏水,对实验无影响,故D正确;
故选A.
点评 本题考查配制一定浓度的溶液,为高频考点,把握浓度、体积、物质的量的关系为解答的关键,侧重分析与应用能力的考查,注意结合公式分析误差,题目难度不大.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:解答题
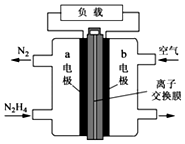 (1)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
(1)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
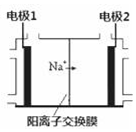 电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”.在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.其中图2是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息,通电以后,Na+向右侧移动,可判断出电极2 是阴极,在该电极周围的溶液中,NaOH浓度将会变大(填“变大”或“减小”或“不变”);电极1上的电极反应式为2Cl--2e-=Cl2↑.
电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”.在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.其中图2是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息,通电以后,Na+向右侧移动,可判断出电极2 是阴极,在该电极周围的溶液中,NaOH浓度将会变大(填“变大”或“减小”或“不变”);电极1上的电极反应式为2Cl--2e-=Cl2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
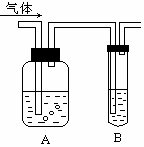 如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )| 选项 | 气体 | A中试剂 | B中试剂 |
| A | SO2、CO2 | 酸性KMnO4溶液 | 品红溶液 |
| B | Cl2、HCl | 浓硫酸 | KI淀粉溶液 |
| C | NH3、CO2 | 浓硫酸 | 酚酞试液 |
| D | C2H4、CH4 | 酸性KMnO4溶液 | 溴的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第一电离能:Y一定小于X | |
| B. | 气态氢化物的稳定性:HmY小于HnX | |
| C. | 最高价含氧酸的酸性:X对应的酸性强于Y对应的 | |
| D. | X和Y形成化合物时,X显负价,Y显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
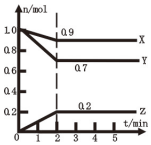 (1)某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.
(1)某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com