
| A. | 干冰升华 | B. | 食盐溶解 | ||
| C. | 氯化铵受热,固体消失 | D. | 电解水 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯乙烯和聚乙烯均能发生加成反应 | |
| B. |  和 和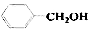 互为同系物 互为同系物 | |
| C. | 用新制氢氧化铜悬浊液能鉴别葡萄糖和乙酸 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗氧气的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:A>D>B>C | B. | 原子半径:D>B>C>A | ||
| C. | 原子序数:C>D>B>A | D. | 简单离子半径:A>B>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 鉴别1-溴丙烷和2-溴丙烷能通过核磁共振仪鉴别,不能用红外光谱仪鉴别 | |
| B. | 仅用物理方法无法鉴别乙醇、甲苯、硝基苯 | |
| C. | 仅用一种试剂能鉴别乙醇、苯、苯酚、2-己烯和四氯化碳 | |
| D. | 用KMnO4酸性溶液能鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥ | B. | ②④⑤ | C. | ①②③④ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| B. | 水加热到很高的温度都难以分解 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | 水结成冰体积膨胀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,杂化方式为sp3,该物质难溶(填“可溶”或“难溶”)于水.
,杂化方式为sp3,该物质难溶(填“可溶”或“难溶”)于水. 与B:
与B: 的沸点高低及其原因:B>A,因为B可以形成分子间氢键
的沸点高低及其原因:B>A,因为B可以形成分子间氢键
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种溶液pH的大小顺序是③>②>④>① | |
| B. | 保持温度不变,将4种溶液稀释相同倍数,pH变化最大的是② | |
| C. | 向4种溶液中分别加入25mL 0.1mol/L盐酸后,pH最大的是① | |
| D. | pH均为9时,4种溶液的物质的量浓度的大小顺序是②>③>④>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com