
|
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:不详 题型:实验题
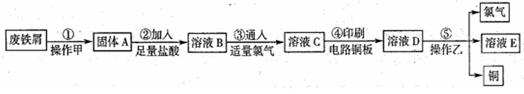
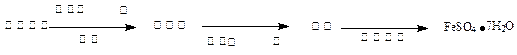 (3)丙同学为测试一铁片中铁元素的含量,在实验室中用m g铁片完全溶解于过量稀硫酸中,准确测定出反应生成氢气的体积为V mL (已折算成标准状况),则该铁片中铁的质量分数为(用含m、V的代数式表示) 。若排除实验仪器和操作的影响因素,试对上述方案测定结果的准确性做出判断和分析:方案 (填“准确”“不准确”“不一定准确”),理由是
(3)丙同学为测试一铁片中铁元素的含量,在实验室中用m g铁片完全溶解于过量稀硫酸中,准确测定出反应生成氢气的体积为V mL (已折算成标准状况),则该铁片中铁的质量分数为(用含m、V的代数式表示) 。若排除实验仪器和操作的影响因素,试对上述方案测定结果的准确性做出判断和分析:方案 (填“准确”“不准确”“不一定准确”),理由是 查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
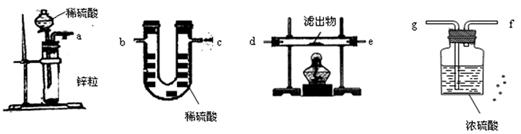
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
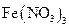 溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究: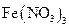 溶液反应,发现银镜溶解。
溶液反应,发现银镜溶解。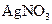 溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止 具有氧化性,能氧化Ag。
具有氧化性,能氧化Ag。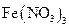 溶液显酸性,在此酸性条件下
溶液显酸性,在此酸性条件下 能氧化Ag。
能氧化Ag。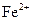 ,验证了假设1的成立。请写出
,验证了假设1的成立。请写出 氧化Ag的离子方程式: 。
氧化Ag的离子方程式: 。 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。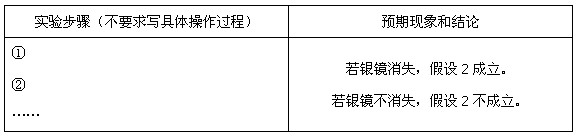
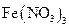 溶液中的
溶液中的 和
和 都氧化了Ag。你是否同意丙同学的结论,并简述理由: 。
都氧化了Ag。你是否同意丙同学的结论,并简述理由: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
|
|
| 猜想 | 验证方法 | 预测现象及结论 |
| 认为铜片中可能含有锌等杂质 | | |
| 猜想 | 预计验证方法 | 猜想的现象与结论 |
| 白色沉淀是氯化亚铜 | | |
| | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

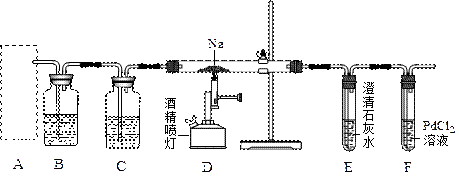
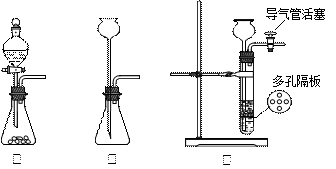
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4NO2(g);△H>0,下表为反应在某温度下的部分实验数据
4NO2(g);△H>0,下表为反应在某温度下的部分实验数据| t/s | 0 | 500 | 1000 |
| c(N2O3)/mol·L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
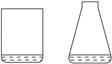
| A.甲比乙易挥发 | B.甲的沸点比乙高 | C.甲的熔点比乙小 | D.甲与乙都能挥发 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com