
| A. | 6 | B. | 5 | C. | 4 | D. | 3 |
分析 3A(g)十B(g)?nC(g)+2D(g)达到平衡后,混合气体的平均摩尔质量减小,则该反应为气体体积增大的反应,A物质的量浓度减小$\frac{1}{2}$,可计算A转化的浓度,混合气体的平均摩尔质量减小$\frac{1}{4}$,因物质均为气态,总质量不变,所以平衡时气体的总的物质的量比上起始态气体的物质的量等于4:3,以此来解答.
解答 解:在一个容积为VL的密闭容器中放入1LA(g)和1L B(g),在一定条件下发生下列反应:3A(g)十B(g)?nC(g)+2D(g),设体积为1L,
达到平衡后,混合气体的平均摩尔质量增大,由M=$\frac{m}{n}$可知,
A、B、C、D均为气体,由质量守恒定律可知,气体的总质量不变,所以平衡时气体的总的物质的量比上起始态气体的物质的量等于4:3
达到平衡后,A物质的量浓度减小$\frac{1}{2}$,
3A(g)十B(g)?nC(g)+2D(g)
起始量 1 1 0 0
变化量 0.5 $\frac{0.5}{3}$ $\frac{0.5n}{3}$ $\frac{1}{3}$
平衡量 0.5 $\frac{2.5}{3}$ $\frac{0.5n}{3}$ $\frac{1}{3}$
2:(0.5+$\frac{2.5}{3}$+$\frac{0.5n}{3}$+$\frac{1}{3}$)=3:4
n=6,故选A.
点评 本题考查化学平衡的计算,明确混合气体平均摩尔质量增大得出反应前后气体物质的量之比等于气体摩尔质量反比是解题的关键,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
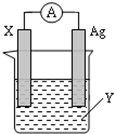 依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s) 设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s) 设计的原电池如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁烷的一氯代物有5种 | B. | 丙烷分子中所有原子共平面 | ||
| C. | 符合通式CnH2n+2的均属于烷烃 | D. | 以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
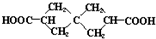 (也可表示为
(也可表示为 )是一种重要的药物中间体,现欲通过如下途径合成:
)是一种重要的药物中间体,现欲通过如下途径合成: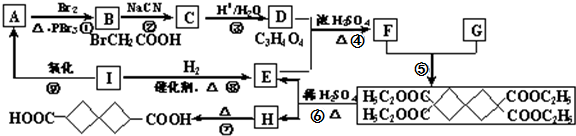
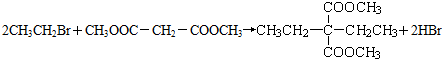
 ;该反应的类型是取代反应或水解反应.
;该反应的类型是取代反应或水解反应. -COOH,则X的结构简式为BrCH2CH2Br.
-COOH,则X的结构简式为BrCH2CH2Br.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
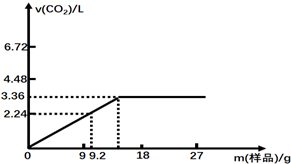
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
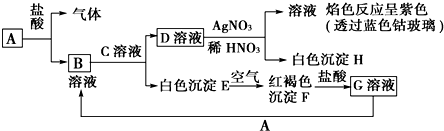
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com