
| A. | MgCl2 | B. | NaOH | C. | O2 | D. | C6H6 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,铵根离子和酸根离子之间存在离子键,据此分析解答.
解答 解:A.氯化镁中镁离子和氯离子之间只存在离子键,故A错误;
B.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,故B正确;
C.氧气分子中O-O原子之间只存在共价键,故C错误;
D.苯分子中C-C、C-H原子之间只存在共价键,故D错误;
故选B.
点评 本题考查化学键判断,为高频考点,侧重考查学生分析、比较、判断能力,明确离子键和共价键根本区别是解本题关键,注意:不能根据是否含有金属元素判断离子键,如氯化铝中只含共价键,铵盐中含有离子键.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 各组成元素质量分数相同的烃是同一种烃 | |
| B. | 结构相似,组成上相差一个或若干个CH2原子团的有机物是同系物 | |
| C. | 能使溴的四氯化碳溶液褪色的烃一定是烯烃 | |
| D. | C3H6和C4H8不一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
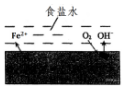 在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现.铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图.下列说法正确的是( )
在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现.铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图.下列说法正确的是( )| A. | 铁片发生还原反应而被腐蚀 | |
| B. | 此过程中电子从C移向Fe | |
| C. | 铁片腐蚀中负极发生的电极反应:2H2O+O2+4e-═4OH- | |
| D. | 铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
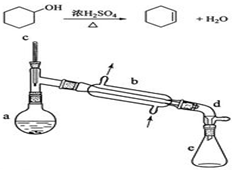 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com