
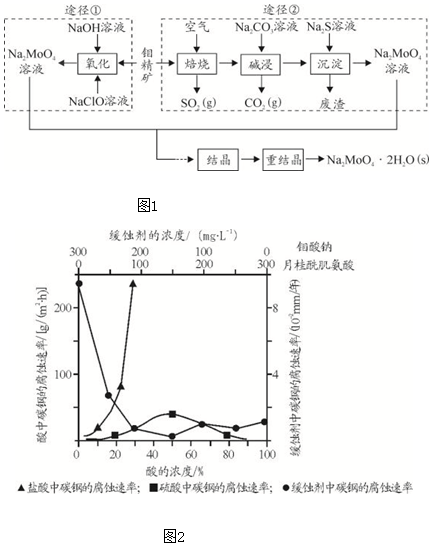

分析 利用钼精矿(主要成分是MoS2)制备钼酸钠有两种途径:途径①是直接用NaClO溶液在碱性条件下氧化钼精矿得到钼酸钠溶液,结晶后得到钼酸钠晶体;途径②是先在空气中灼烧生成MnO3,同时得到对环境有污染的气体SO2,然后再用纯碱溶液溶解MnO3,即可得到钼酸钠溶液,最后结晶得到钼酸钠晶体.
Ⅰ、(1)NaClO是一种强氧化剂;
(2)通常可以增加空气的流通量、固体粉碎或逆流焙烧等措施来提高焙烧效率;
(3)途径①用NaClO在碱性条件下氧化MoO3,得到钼酸钠和NaCl和水,同时有SO42-生成,据此可写出离子反应方程式;
(4)使用的次数较多后,母液中杂质的浓度增大,影响产品纯度;
(5)根据钼酸钡和硫酸钡的溶度积计算出溶液中硫酸根离子的浓度,在再计算出SO42-的去除率;
II、(1)根据图示数据分析碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异的原因;
(2)根据图象分析,在缓蚀剂中碳钢的腐蚀速率速率最小,腐蚀效果最好,最好的腐蚀效果在中点处,即钼酸钠的浓度150mg•L-1,据此计算出钼酸钠的物质的量浓度.
解答 解:I.(1)NaClO是一种强氧化剂,所以贴在装有NaClO容器上的是B;
故答案为:B;
(2)提高焙烧效率,除增大空气量外还可以采用的措施是充分粉碎或逆流焙烧;
故答案为:充分粉碎矿石或逆流焙烧;
(3)途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
故答案为:MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(4)由于母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度;
故答案为:母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度;
(5)BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)=$\frac{4.0×1{0}^{-8}}{0.40}$molL=1×10-7mol/L,
溶液中硫酸根离子的浓度为:c(SO42-)=$\frac{1.1×1{0}^{-10}}{1×1{0}^{-7}}$mol/L=1.1×10-3mol/L,
硫酸根离子的去除率为:1-$\frac{1.1×1{0}^{-3}}{0.04}$×100%=1-2.75%≈97.3%;
故答案为:97.3%;
II.(1)由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢;
故答案为:Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;硫酸溶液随着浓度的增大,氧比性增强,会使钢铁钝化,腐蚀速率减慢;
(2)根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,
所以钼酸钠的浓度为:150mg•L-1,
1L溶液中含有的钼酸钠物质的量为:$\frac{150×1{0}^{-3}}{206g/mol}$≈7.28×10-4mol,
所以钼酸钠溶液的物质的量浓度为:7.28×l0-4mol•L-1;
故答案为:7.28×l0-4mol•L-1.
点评 本题考查了制备钼酸钠晶体的方法,注意分析题中图示是解题关键,最后一问有一定的难度,容易出错,需要合理应用题中数据,本题难度中等.


科目:高中化学 来源: 题型:选择题
 短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为黄色固体,易溶在XZ2中,p是一种二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )
短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为黄色固体,易溶在XZ2中,p是一种二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )| A. | 原子半径:W<X<Y | |
| B. | W与X组成的化合物中可能含有极性键和非极性键 | |
| C. | Y与Z组成的化合物一定有漂白性 | |
| D. | W与X、Y、Z组成的简单化合物的稳定性:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
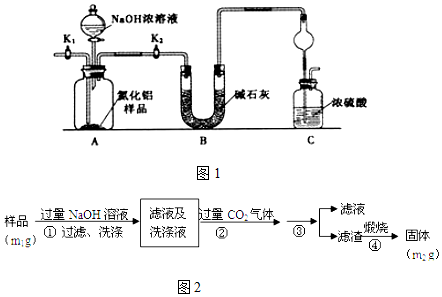
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
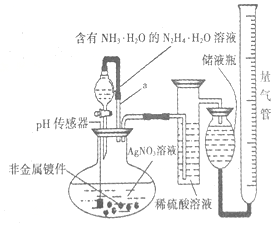 化学镀银法是非金属表面镀银的常用方法,如图是研究化学镀银中银元素利用率的实验装置(夹持仪器略):
化学镀银法是非金属表面镀银的常用方法,如图是研究化学镀银中银元素利用率的实验装置(夹持仪器略): .已知稀硝酸的氧化性强于Ag+,NH3•H2O中加适量氨水的一个重要目的是控制溶液的pH在8-9之间,简述溶液不能呈酸性的理由如果溶液呈酸性,被还原的是HNO3,而得不到银单质,从而导致实验失败.
.已知稀硝酸的氧化性强于Ag+,NH3•H2O中加适量氨水的一个重要目的是控制溶液的pH在8-9之间,简述溶液不能呈酸性的理由如果溶液呈酸性,被还原的是HNO3,而得不到银单质,从而导致实验失败.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为除去酸性CuCl2溶液中含有的少量Fe3+,可在加热、搅拌的条件下加入氨水,过滤后,再向滤液中加入适量盐酸 | |
| B. | 在工业合成NH3的反应中,采取高温措施 | |
| C. | 恒温下,对平衡体系H2(g)+Br2(g)?2HBr(g)加压,可使气体颜色变深 | |
| D. | 向饱和氯化钠溶液中不断缓慢地通入HCl气体,会析出晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应完全停止 | B. | 各物质的浓度保持不变 | ||
| C. | 反应物消耗完全 | D. | 正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1标准大气压下原子数为NA的水蒸气为1mol | |
| B. | 1L1mol/L的NaOH溶液中Na+的物质的量为1mol | |
| C. | 标准状况下,22.4L氦气的质量为4g | |
| D. | 用含1molHCl的盐酸制取氯气,氯元素失去的电子数为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com