
| A. | 漂白粉与浓盐酸反应可制取氯气 | |
| B. | 用FeS与稀硝酸制取硫化氢 | |
| C. | 浓硫酸与碘化钠共热制取碘化氢 | |
| D. | 用浓溴水除去苯中溶有的少量的苯酚 |
分析 A.漂白粉中含有氯离子、次氯酸根离子,酸性条件下二者能够反应生成氯气;
B.稀硝酸具有强氧化性,能够氧化硫化氢;
C.浓硫酸具有强氧化性,能够将HI氧化成碘单质;
D.溴、三溴苯酚都能够溶于苯,无法达到除杂的目的.
解答 解:A.漂白粉的成分为氯化钙和次氯酸钙,酸性条件下氯离子、次氯酸根离子发生反应生成氯气,故A正确;
B.FeS与稀硝酸发生氧化还原反应生成S单质,无法制取硫化氢,故B错误;
C.浓硫酸与碘化钠发生氧化还原反应生成碘单质,无法用浓硫酸和碘化钠共热制取碘化氢,可以用浓磷酸,故C错误;
D.苯酚与溴反应生成的三溴苯酚溶于苯,无法用浓溴水除去苯中的苯酚,可以用氢氧化钠溶液,故D错误;
故选A.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及气体制备、物质分离与提纯等知识,明确常见物质制备原理为解答关键,注意掌握物质分离与提纯原则,试题有利于培养学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
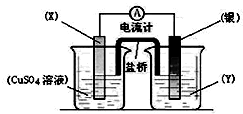 用如图装置实现原电池反应:Cu+2Ag+═Cu2++2Ag
用如图装置实现原电池反应:Cu+2Ag+═Cu2++2Ag查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 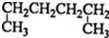 1,4-二甲基丁烷 1,4-二甲基丁烷 | B. | 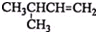 3-甲基丁烯 3-甲基丁烯 | ||
| C. | 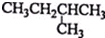 2-甲基丁烷 2-甲基丁烷 | D. | CH2Cl-CH2Cl 二氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,3?二甲基戊烷 | B. | 2?甲基??3 乙基丁烷 | ||
| C. | 3,4?二甲戊烷 | D. | 2,3?二甲基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
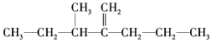 的系统命名为:3-甲基-2-丙基-1-戊烯
的系统命名为:3-甲基-2-丙基-1-戊烯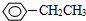 ③?H COOH、④CH3COOC2H5.
③?H COOH、④CH3COOC2H5.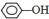 ;②CH2=CH2;③CH≡CH;④
;②CH2=CH2;③CH≡CH;④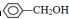 ;⑤
;⑤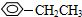 ;
;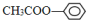 ;⑦CH3CH2CH2CH2Br中能与NaOH溶液反应,但不能与Na2CO3溶液反应的是⑥⑦. (填写上述物质的序号)
;⑦CH3CH2CH2CH2Br中能与NaOH溶液反应,但不能与Na2CO3溶液反应的是⑥⑦. (填写上述物质的序号)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4++OH-→NH3•H2O | B. | 2Na+2H2O→2Na++2OH-+H2↑ | ||
| C. | HCO3-+OH-→H2O+CO32- | D. | 2Na+2H2O→2NaOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 吸氧腐蚀比析氢腐蚀更加普遍,因为吸氧腐蚀的速度比析氢腐蚀快 | |
| B. | 铁闸门与直流电源正极相连从而防止闸门腐蚀的方法称为外接直流电源的阴极保护法 | |
| C. | 金属的电化学腐蚀比化学腐蚀更普通 | |
| D. | 用原电池的原理保护金属的方法称为牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-542.7kJ/mol | |
| B. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1059.3kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1076.7kJ/mol | |
| D. | N2H4(g)+$\frac{1}{2}$N2O4(g)=$\frac{3}{2}$N2(g)+2H2O(g)△H=-1076.7kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com