
�������繤ҵ���õķ�չ���˿ڵľ�����ȫ����Դ���ż�������������Խ��Խ���ص����⣬��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2������ȫ������ձ����ӡ�
��1����ͼΪC����������ı仯��ϵͼ�����ٱ仯���û���Ӧ�����仯ѧ����ʽ��Ϊ______________________________________��
ͼ�б仯������Щ�����ȷ�Ӧ________������ţ���
��2���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ�Ͽ������·����ϳɼ״���
����һ��CO��g����2H2��g��??CH3OH��g��
��������CO2��g����3H2��g��??CH3OH��g����H2O��g��
��25�桢101 kPa�£�1�˼״���ȫȼ�շ���22.68 kJ��д���״�ȼ�յ��Ȼ�ѧ����ʽ��_____________________________________________��
ij�������糧CO2������ŷ�����2 200��֣�������CO2��ȫת��Ϊ�״������������ɴ˻�õļ״���ȫȼ�շ���Լ��________kJ��������λ��Ч���֣���
��3��������ұ������������һ����Ӧ�ǽ�ԭ�Ͻ��ʯת����TiO2�����ʯ����2C��2Cl2����,TiCl4��2CO����֪��C��s����O2��g��=CO2��g������H����393.5 kJ��mol��1
2CO��g����O2��g��=2CO2��g������H����566 kJ��mol��1
TiO2��s����2Cl2��g��=TiCl4��s����O2��g������H����141 kJ��mol��1
��TiO2��s����2Cl2��g����2C��s��=TiCl4��s����2CO��g���Ħ�H��________��
��4�����������ھ�������������ˮ������������ҵ�������ΪƯ�����������������������ҿ������������е��ʷ�Ӧ���磺
6Ag��s����O3��g��=3Ag2O��s������H����235.8 kJ��mol��1��
��֪��2Ag2O��s��=4Ag��s����O2��g����H����62.2 kJ��mol��1��
��O3ת��ΪO2���Ȼ�ѧ����ʽΪ_________________________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�״�����Ϊȼ�ϵ�ص�ԭ�ϡ�ͨ�����з�Ӧ�����Ʊ��״���CO ( g ) + 2H2 ( g )  CH3OH ( g ) ��H��-90.8 kJ��mol��1 ��һ�ݻ��ɱ���ܱ������г���10 mol CO ��20 molH2��CO ��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ��ʾ�����ﵽƽ��״̬A ʱ�����������Ϊ20 L��
CH3OH ( g ) ��H��-90.8 kJ��mol��1 ��һ�ݻ��ɱ���ܱ������г���10 mol CO ��20 molH2��CO ��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ��ʾ�����ﵽƽ��״̬A ʱ�����������Ϊ20 L��
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ ��
��2���練Ӧ��ʼʱ�Գ���10mol CO ��20mol H2��
����ƽ��״̬Bʱ���������V��B��= L��
��3�����ڷ�ӦCO(g)+2H2(g) CH3OH(g)�ڻ�ѧƽ��״̬ʱ��������ȷ���� ������ĸ����
CH3OH(g)�ڻ�ѧƽ��״̬ʱ��������ȷ���� ������ĸ����
A��CO�ĺ������ֲ���
B��������CH3OHŨ����COŨ�����
C��2V����CH3OH��=V����H2��
D�������л�������ƽ����Է����������ֲ���
��4��CO(g)+2H2(g) CH3OH(g)��������ͬ�����ʵ��� Ͷ�ϣ����CO�� ��ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���� ��
CH3OH(g)��������ͬ�����ʵ��� Ͷ�ϣ����CO�� ��ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���� ��
A���¶ȣ�T1 < T2 <T3
B������Ӧ���ʣ��ͣ�a��>�ͣ�c���� �ͣ�b��>�ͣ�d��
C��ƽ�ⳣ���� K(a) ="K(c)" �� K(b) >K(d)
D��ƽ��Ħ��������M(a)<M(c)�� M(b)>M(d)
��5����֪CO2��g��+H2��g�� CO��g��+H2O��g�� ��H=" +" 41.3 kJ��mol��1����д���� CO2��H2��ȡ�״����Ȼ�ѧ����ʽ ��
CO��g��+H2O��g�� ��H=" +" 41.3 kJ��mol��1����д���� CO2��H2��ȡ�״����Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����еIJ��ֵ�Դ��O3�Ժ�ˮ��I������������O3����ͨ��NaI������Һ��Һ�н���ģ���о���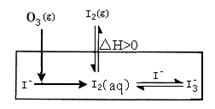
��1��O3��I��������I2�Ĺ��̿ɷ������·�Ӧ��
��I����aq��+ O3��g��= IO��(aq) +O2��g����H1
��IO����aq��+H+(aq)  HOI(aq) ����H2
HOI(aq) ����H2
��HOI(aq) + I��(aq) + H+(aq) I2(aq) + H2O(l) ��H3
I2(aq) + H2O(l) ��H3
��O3��g��+2I����aq��+2H+��aq��=��I2(aq) + O2��g��+ H2O(l) ��H4
���H3���H1����H2����H4֮��Ĺ�ϵ�ǣ���H3 = ��
��2������Һ�д��ڻ�ѧƽ�⣺ I2(aq) + I��(aq)  I3��(aq)��ƽ�ⳣ������ʽΪ ���ڷ�Ӧ������������I3�����ʵ���Ũ�ȱ仯����� ��
I3��(aq)��ƽ�ⳣ������ʽΪ ���ڷ�Ӧ������������I3�����ʵ���Ũ�ȱ仯����� ��
��3��Ϊ̽���¶���I2(aq) + I��(aq) I3��(aq) ��H5 ��Ӧ��Ӱ�졣��ij�¶�T1�£���һ������0.2 mol��L-1NaI������Һ�����ܱ������У�������һ������O3��g����O3���岻�㣬������������O2�� I����Ӧ������tʱ�̣����������I2��g����Ũ�ȡ�Ȼ��ֱ����¶�ΪT2��T3��T4��T5�£�����������ʼʵ���������䣬�ظ�����ʵ�飬������ͬʱ����I2��g��Ũ�ȣ��õ�����ͼ����ͼһ������
I3��(aq) ��H5 ��Ӧ��Ӱ�졣��ij�¶�T1�£���һ������0.2 mol��L-1NaI������Һ�����ܱ������У�������һ������O3��g����O3���岻�㣬������������O2�� I����Ӧ������tʱ�̣����������I2��g����Ũ�ȡ�Ȼ��ֱ����¶�ΪT2��T3��T4��T5�£�����������ʼʵ���������䣬�ظ�����ʵ�飬������ͬʱ����I2��g��Ũ�ȣ��õ�����ͼ����ͼһ������
������T3ʱ����������O3�� T4��T5�¶�����������I2��g��Ũ�ȳ�����ͼһ��ʾ�ı仯���ƣ����H5 0(�������)�������������¶�ΪT4ʱ����Һ��I��Ũ����ʱ��仯������������ͼ����ʾ����t2ʱ�����÷�Ӧ��ϵ�¶�������T5����ά�ָ��¶ȡ�����ͼ2�л���t2ʱ�̺���Һ�� I��Ũ�ȱ仯���������ߡ�
������T3ʱ�������л���O3����T1��T2�¶�����������I2��g��Ũ�ȳ�����ͼһ��ʾ�ı仯���ƣ�����ܵ�ԭ���� ������дһ�㣩
��4�����÷�Ӧ�ܺ�ͼ2����Ϣ������0-t1ʱ�������I2(aq)��ʾ�Ļ�ѧ��Ӧ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���Ŵ�����Ⱦ����������,�����ܼ��š�,����ȫ�����������ŷ�,�о�NOx��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
(1)��ͼ����101 kPa��298 K������1 mol NO2��1 mol CO��Ӧ����1 mol CO2��1 mol NO�����������仯ʾ��ͼ��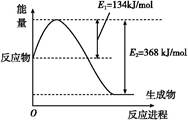
��֪:N2(g)+O2(g) 2NO(g)����H="+179.5" kJ/mol
2NO(g)����H="+179.5" kJ/mol
2NO(g)+O2(g) 2NO2(g)����H="-112.3" kJ/mol
2NO2(g)����H="-112.3" kJ/mol
����298 Kʱ,��Ӧ:2NO(g)+2CO(g) N2(g)+2CO2(g)�Ħ�H=��������
N2(g)+2CO2(g)�Ħ�H=�������� 
(2)��0.20 mol NO2��0.10 mol CO ����һ���ݻ��㶨Ϊ1 L���ܱ������з�����Ӧ,�ڲ�ͬ������,��Ӧ�����в������ʵ�Ũ�ȱ仯״����ͼ��ʾ��
������˵����ȷ������������(�����)��
a.�����ڵ�ѹǿ�������仯˵���÷�Ӧ�ﵽƽ��
b.�����������ٳ���0.20 mol NOʱ,ƽ��������Ӧ�����ƶ�,Kֵ����
c.�����¶Ⱥ�,Kֵ��С,NO2��ת���ʼ�С
d.��������ڳ���He��,��Ӧ��������С,Ũ������,���Է�Ӧ��������
�ڼ������NO2��0��2 minʱƽ����Ӧ����v(NO2)=��������mol/(L��min)��
�۵�4 minʱ�ı�ķ�Ӧ����Ϊ��������(����¡����¡�)��
�ܼ��㷴Ӧ�ڵ�6 minʱ��ƽ�ⳣ��K=�����������������¶Ȳ���,��ʱ���������г���CO��NO��0.060 mol,ƽ�⽫���������ƶ�(�������������)�� 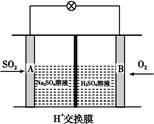
(3)��ѧ��������ͼ��ʾװ����ԭ���ԭ����SO2ת��Ϊ��Ҫ�Ļ���ԭ�ϡ��为���ķ�ӦʽΪ ������0.25 mol SO2������,��ͨ������(H+)����Ĥ��H+�����ʵ���Ϊ�������� ��
(4)CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ,CaCO3��һ����������,��Ksp=2.8��10-9���ֽ�2��10-4 mol/L��Na2CO3��Һ��һ��Ũ�ȵ�CaCl2��Һ�����������ɳ���,����Ӧ����CaCl2��Һ����СŨ��Ϊ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ǵؿ��к�����ߵĽ���Ԫ�أ��䵥�ʼ��Ͻ������������е�Ӧ�������㷺��
���̼�Ȼ�ԭ���Ȼ�����ʵ�����������Ʊ�������������ط�Ӧ���Ȼ�ѧ����ʽ���£�
Al2O3(s)��AlCl3(g)��3C(s)=3AlCl(g)��3CO(g)
��H��a kJ��mol��1
3AlCl(g)=2Al(l)��AlCl3(g)��H��b kJ��mol��1
(1)��ӦAl2O3(s)��3C(s)=2Al(l)��3CO(g)�Ħ�H��________kJ��mol��1(�ú�a��b�Ĵ���ʽ��ʾ)��
(2)Al4C3�Ƿ�Ӧ�����е��м���Al4C3�����ᷴӦ(����֮һ�Ǻ�������ߵ���)�Ļ�ѧ����ʽΪ______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
̼���������ĵ��ʼ��仯�����ڹ�ũҵ����������������Ҫ���á�
��1�����̼�Ȼ�ԭһ�Ȼ�����ʵ���������Ʊ�������������ص��Ȼ�ѧ����ʽ���£�
2Al2O3��s��+ 2AlCl3��g��+ 6C��s����6AlCl��g��+ 6CO��g������H�� a kJ?mol-1
3AlCl��g���� 2Al��l��+ AlCl3��g������H�� b kJ?mol-1
��ӦAl2O3��s��+ 3C��s���� 2Al��l��+ 3CO��g���ġ�H�� kJ?mol-1
���ú�a��b�Ĵ���ʽ��ʾ����
��2���û���̿��ԭ�����Դ����������ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO��������ӦC��s��+ 2NO��g�� N2��g��+ CO2��g������H= Q kJ?mol-1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2��g��+ CO2��g������H= Q kJ?mol-1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
| ʱ�䣨min�� Ũ�ȣ�mol/L�� | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1��00 | 0��68 | 0��50 | 0��50 | 0��60 | 0��60 |
| N2 | 0 | 0��16 | 0��25 | 0��25 | 0��30 | 0��30 |
| CO2 | 0 | 0��16 | 0��25 | 0��25 | 0��30 | 0��30 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧ��Ҫ�о���̼Ԫ�ؼ��仯������صĺܶ���⡣
��1����̿��������ȡˮú�������12g̼��ˮ������ȫ��Ӧ����ˮú��ʱ��������131. 6kJ�������÷�Ӧ���Ȼ�ѧ����ʽ��_________ ��
��2����ҵ�Ͽ��ý�̿ұ����������0.5mol̼��ȫ�������Ӧ���õ�0.6mol����ͬʱ����2�ֳ������壬��÷�Ӧ�Ļ�ѧ����ʽ��_________��
��3��̼��ˮ������ˮú���ķ�Ӧ��һ�����淴Ӧ��������������жϸ÷�Ӧһ���ﵽƽ��״̬����_________��ѡ���ţ�����
| A��V��(H2O)=V��(H2) |
| B���������¶Ȳ��ٷ����ı� |
| C������nmolH2ͬʱ����nmolCO |
| D������������������ʵ�������ʱ��ı� |
 CO(g)+H2(g)��ƽ�ⳣ������ֵΪ_________���ڵ�5����ʱ����ϵ���·����ߵ�T2�����ڵ�8����ʱ�ﵽ�µ�ƽ�⣬������ͼ�л�����5���ӵ�9���Ӻ�c(H2O)Ũ�ȱ仯���Ƶ����ߣ�ֻҪ���Ա�ʾ����
CO(g)+H2(g)��ƽ�ⳣ������ֵΪ_________���ڵ�5����ʱ����ϵ���·����ߵ�T2�����ڵ�8����ʱ�ﵽ�µ�ƽ�⣬������ͼ�л�����5���ӵ�9���Ӻ�c(H2O)Ũ�ȱ仯���Ƶ����ߣ�ֻҪ���Ա�ʾ����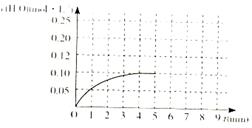
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������Ϊһ������Դ�ڻ�ѧ����Ӧ�ù㷺����ش��������⡣
(1)��¯ұ�������У������ڴ���Ӧ���в���ˮú��(CO��H2)��ԭ���������йط�ӦΪ��CH4(g)��CO2(g)===2CO(g)��2H2(g)����H��260 kJ��mol��1
��֪��2CO(g)��O2(g)===2CO2(g)
��H����566 kJ��mol��1��
��CH4��O2��Ӧ����CO��H2���Ȼ�ѧ����ʽΪ_________________________________��
(2)����ͼ��ʾ��װ�â�Ϊ����ȼ�ϵ��(�������ҺΪKOH��Һ)��ͨ��װ�â�ʵ�������϶�ͭ��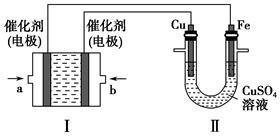
��a��Ӧͨ��________(�CH4����O2��)��b���缫�Ϸ����ĵ缫��Ӧʽ��__________________________________��
�ڵ�ƽ�����װ�â�����Һ��pH________(��д�������С�����䡱����ͬ)��װ�â���Cu2�������ʵ���Ũ��________��
�۵�ƽ�����װ�â���Һ�е������ӳ���OH���������________(����ˮ��)��
���ڴ˹���������ȫ��Ӧ��װ�â������������仯12.8 g����װ�â������������ļ���________L(��״����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1����101kPa�£�CH4(g)��H2(g)��C(s)��ȼ���ȷֱ�Ϊ890.3kJ?mo1��1��285.8kJ?mo1��1��393.5kJ?mo1��1����ӦC(s)+2H2(g)=CH4(g)�ķ�Ӧ�Ȧ�H= ��
��2����֪��2H2(g)+O2(g)=2H2O(g) ��H1
2H2(g)+O2(g)=2H2O(l) ��H2
2CO(g)+O2(g)=2CO2(g) ��H3
��Һ̬ˮת��Ϊ��̬ˮ���Ȼ�ѧ����ʽΪ ��
��CO��H2�ֱ�ȼ������CO2 (g)��H2O(g)�����õ���ͬ����������CO��H2��������� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com