
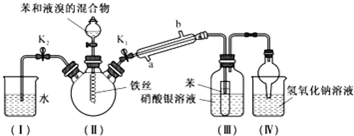
分析 (1)冷凝管的使用方法是水流方向逆流冷凝效果好;
(2)溴易挥发及易溶于有机溶剂;
(3)生成浅黄色沉淀溴化银,说明存在溴离子,若把III中盛于洗气瓶内的硝酸银溶液换为石蕊试液,会变红色;
(4)装置II中含有溴化氢气体能污染空气;
(5)装置III中的导管没有与溶液接触,能防倒吸,IV中干燥管上方面积较大,液体在此能回落;
(6)通过蒸馏方法获得纯净的溴苯.
解答 解:(1)冷凝管采用逆向通水,即从a进水,使气体与水充分接触,冷凝效果好,
故答案为:a;
(2)Ⅲ中小试管内苯的作用是除去溴化氢中的溴蒸气,避免干扰溴离子检验,
故答案为:吸收溴蒸气;
(3)因从冷凝管出来的气体为溴化氢,溴化氢不溶于苯,溴化氢能与硝酸银反应生成溴化银沉淀,若把III盛于洗气瓶内的硝酸银溶液换为石蕊试液,溶液变红色说明生成了HBr,
故答案为:Ⅲ中硝酸银溶液内有浅黄色沉淀生成;石蕊;溶液变红;
(4)因装置Ⅱ中含有溴化氢气体能污染空气,使I的水倒吸入Ⅱ中可以除去溴化氢气体,以免逸出污染空气;操作方法为开启K2,关闭K1和分液漏斗活塞,
故答案为:反应结束后装置Ⅱ中存在大量的溴化氢,使I的水倒吸入Ⅱ中可以除去溴化氢气体,以免逸出污染空气;开启K2,关闭K1和分液漏斗活塞;
(5)装置III中的导管没有与溶液接触,能防倒吸,IV中干燥管上方面积较大,当液体倒吸后考自身重量回落防止了倒吸,
故答案为:Ⅲ、Ⅳ;
(6)加入无水CaCl2粉末干燥,然后通过蒸馏操作,获得纯净的溴苯,故答案为:蒸馏.
点评 本题主要考查了苯的性质实验,掌握反应的原理、各物质的性质以及操作的方法是解题的关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成3n molX,同时生成n mol Y | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | X、Y、Z的浓度不再改变 | |
| D. | X、Y、Z的分子个数比为3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3+H2O?NH4++OH- | |
| B. | HCO3-+H2O?H2CO3+OH- | |
| C. | Cu2++2H2O?2Cu(OH)2+2H+ | |
| D. | 2 Fe3++3H2O+3CO32-=2Fe(OH)3↓+3CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P、S、Cl三种元素的最高价氧化物对应水化物酸性依次增强 | |
| B. | Na、Mg、Al三种元素的原子半径依次减小 | |
| C. | F、Cl、Br三种原子的核外电子层数依次增多 | |
| D. | 、N、O、F三种元素的非金属性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
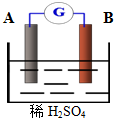 如图为原电池装置:
如图为原电池装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Fe2+、SO42-、NO3- | B. | Al3+、Na+、HCO-3、Cl- | ||
| C. | Fe3+、K+、Cl-、SCN- | D. | K+、SO2-4,Na+、NO-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
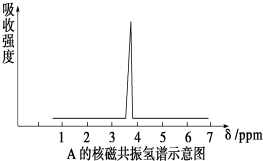
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
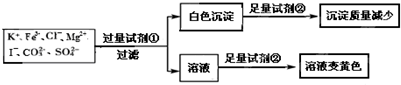
| A. | 试剂①为硝酸钡 | |
| B. | 试剂②一定为盐酸 | |
| C. | 该溶液中一定有 I-、CO32-、SO42-、K+ | |
| D. | 通过在黄色溶液中加入硝酸银溶液可以检验原溶液中是否存在Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com