
 2C(g)�ﵽƽ��ʱ�������ʵ�
2C(g)�ﵽƽ��ʱ�������ʵ� 2C(g)�ﵽƽ��ʱ�������ʵ�ƽ��Ũ�ȷֱ�Ϊ��c(A2)��0.5 mol��L-1��c(B2)��0.1 mol��L-1��c(C)��1.6 mol��L-1����B2(g)��ȫ��Ӧ����aΪ0.4����bΪ0����Cȫ��ȫ��ת��ΪA2(g)+B2(g)����aΪ1.3��bΪ0.9�����Ԣ�a��bӦ����Ĺ�ϵʽ��a=b+0.4���������Ǽ���״̬����a��ȡֵ��Χ��0.4<a<1.3����2���º�N2O4��Ӧ���Ȼ�ѧ����ʽ�����ɢ�N2H4(1)+O2(g)="===" N2(g)+2H2O(g)����2���ټ�ȥ��N2(g)+2O2(g)="===" N2O4�õ������º�N2O4��Ӧ���Ȼ�ѧ����ʽΪ 2N2H4(L)+N2O4(L)====3N2(g)+4H2O(g��H=-1048.9kJ/mol������H=-534.2��2+19.5=-1048.9kJ/mol����
2C(g)�ﵽƽ��ʱ�������ʵ�ƽ��Ũ�ȷֱ�Ϊ��c(A2)��0.5 mol��L-1��c(B2)��0.1 mol��L-1��c(C)��1.6 mol��L-1����B2(g)��ȫ��Ӧ����aΪ0.4����bΪ0����Cȫ��ȫ��ת��ΪA2(g)+B2(g)����aΪ1.3��bΪ0.9�����Ԣ�a��bӦ����Ĺ�ϵʽ��a=b+0.4���������Ǽ���״̬����a��ȡֵ��Χ��0.4<a<1.3����2���º�N2O4��Ӧ���Ȼ�ѧ����ʽ�����ɢ�N2H4(1)+O2(g)="===" N2(g)+2H2O(g)����2���ټ�ȥ��N2(g)+2O2(g)="===" N2O4�õ������º�N2O4��Ӧ���Ȼ�ѧ����ʽΪ 2N2H4(L)+N2O4(L)====3N2(g)+4H2O(g��H=-1048.9kJ/mol������H=-534.2��2+19.5=-1048.9kJ/mol����

 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 TiCl4
TiCl4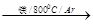 Ti
Ti | A����80kJ��mol-1 | B����160kJ��mol-1 | C��160kJ��mol-1 | D��80kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 CH3OH(g) ��H1
CH3OH(g) ��H1 CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2  CO(g)+3H2(g)��
CO(g)+3H2(g)��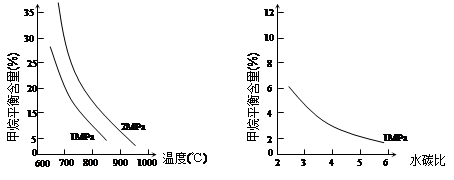

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2������Ӻ�1�������ӷ�Ӧ����2��ˮ���ӣ��ų�����571.6 kJ |
| B��2 mol H2(g)��1 mol O2(g)��Ӧ����2 mol H2O(l)����������571.6 kJ |
| C��2 mol H2O(l)�ֽ�Ϊ2 mol H2(g)��1 mol O2(g)����������571.6 kJ |
| D��2 mol H2(g)��1 mol O2(g)��Ӧ����2 mol H2O(g)���ų�����571.6 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2P2O5(s)����H1��
2P2O5(s)����H1�� 2P2O5(s)����H2����H1�ͦ�H2�Ĺ�ϵ��ȷ����
2P2O5(s)����H2����H1�ͦ�H2�Ĺ�ϵ��ȷ����| A����H1=��H2 | B����H1<��H2 | C����H1>��H2 | D����ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��H2(g) + I2(s) 2HI(g) - 26.5kJ 2HI(g) - 26.5kJ |
B��H2 + I2 2HI - 53kJ 2HI - 53kJ |
C��H2(g) + I2(s) 2HI(g) - 53kJ 2HI(g) - 53kJ |
D��0.5H2 + 0.5I2 HI - 26.5kJ HI - 26.5kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ʯī�Ʊ����ʯ�����ȷ�Ӧ��������ʱ��ʯī�������Ƚ��ʯ�ĵ� |
| B����ʯī�Ʊ����ʯ�����ȷ�Ӧ��������ʱ��ʯī�������Ƚ��ʯ�ĸ� |
| C����ʯī�Ʊ����ʯ�Ƿ��ȷ�Ӧ��������ʱ��ʯī�������Ƚ��ʯ�ĵ� |
| D����ʯī�Ʊ����ʯ�Ƿ��ȷ�Ӧ��������ʱ��ʯī�������Ƚ��ʯ�ĸ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
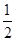 O2(g)===H2O(g)����H����241.8 kJ��mol��1������˵���в���ȷ���� �� ��
O2(g)===H2O(g)����H����241.8 kJ��mol��1������˵���в���ȷ���� �� ��| A��H2��ȼ����Ϊ241.8 kJ��mol��1 |
| B��2H2(g)��O2(g)===2H2O(g)����H����483.6 kJ��mol��1 |
| C��1 mol H2��ȫȼ������Һ̬ˮ�ų�����������241.8 kJ |
| D���Ͽ�1 mol H2O�Ļ�ѧ�����յ����������ڶ���1 mol H2��0.5 mol O2�Ļ�ѧ�������յ������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com