
| A. | a为H2S,SO2+2H++S2-→3 S↓十2H2O | |
| B. | a为Cl2,Ba2++SO2+2 H2O+Cl2→BaSO3↓+4H++2Cl- | |
| C. | a为NO2,4Ba2++4SO2+5H2O+NO3-→4 BaSO4↓+NH4++6 H+ | |
| D. | a为NH3,Ba2++SO2+2 NH3+2H2O→BaSO4↓+2NH4++2H+ |
分析 A.H2S为弱电解质,应写成化学式;
B.应生成BaSO4沉淀;
C.NO2与二氧化硫发生氧化还原反应,结合电荷、电子守恒判断;
D.通入氨气,没有发生氧化还原反应,生成BaSO3沉淀.
解答 解:A.H2S为弱电解质,反应的离子方程式为SO2+2H2S→3 S↓+2H2O,故A错误;
B.氯气具有强氧化性,应生成BaSO4沉淀,反应的离子方程式为Ba2++SO2+2 H2O+Cl2→BaSO4↓+4H++2Cl-,故B错误;
C.NO2与二氧化硫发生氧化还原反应,反应的离子方程式为4Ba2++4SO2+5H2O+NO3-→4 BaSO4↓+NH4++6 H+,故C正确;
D.通入氨气,没有发生氧化还原反应,生成BaSO3沉淀,反应的离子方程式为Ba2++SO2+2 NH3+H2O→BaSO3↓+2NH4+,故D错误.
故选C.
点评 本题考查二氧化硫的化学性质及氧化还原反应,为高频考点,把握发生的氧化还原反应为解答的关键,注意根据反应的特点判断离子方程式,题目难度不大.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
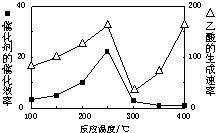 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
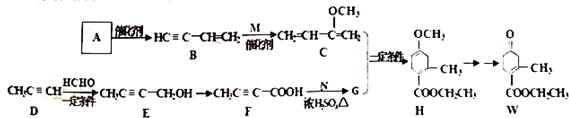
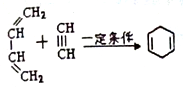 ,请回答下列问题:
,请回答下列问题: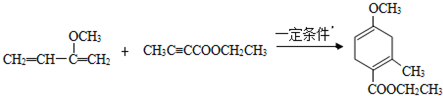 .
.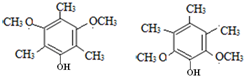 .
.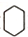 )的合成路线(在相应位置填写有关反应条件及物质的结构简式):
)的合成路线(在相应位置填写有关反应条件及物质的结构简式): $→_{催化剂}^{H_{2}}$
$→_{催化剂}^{H_{2}}$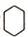
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 | |
| B. | 油脂制肥皂实验中加乙醇的目的是增大油脂的溶解度从而加快油脂皂化反应速率 | |
| C. | 工业合成氨的反应属于能自发进行的反应,故能迅速发生 | |
| D. | 鸡蛋清溶液中加入饱和Na2SO4溶液有沉淀生成是因为蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
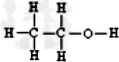 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
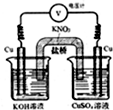 实验室利用如图所示装置.通过测电压求算Cu(OH)2的沉淀溶解平衡常数,工作一段时间后,两电极质量均增大.下列说法不正确的是( )
实验室利用如图所示装置.通过测电压求算Cu(OH)2的沉淀溶解平衡常数,工作一段时间后,两电极质量均增大.下列说法不正确的是( )| A. | 该装置工作时化学能转化为电能 | B. | 左池中的铜电极作正极 | ||
| C. | 总反应为Cu2+(aq)+2OH-(aq)?Cu(OH)2(s) | D. | 盐桥中的K+移向CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$

 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$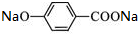 +
+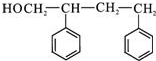 +H2O.
+H2O. (写出其中一种的结构简式).
(写出其中一种的结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
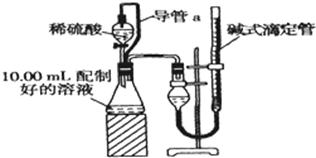 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ba2Cl2、CuSO4、NaOH、NaCl | B. | Na2SO4、BaCl2、K2CO3、KNO3 | ||
| C. | FeCl3、NaOH、Na2SO4、Ba(NO3)2 | D. | NaCl、Na2CO3、Ca(NO3)2、H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com