
| 1 |
| 1+3 |
| 3 |
| 1+3 |


科目:高中化学 来源: 题型:
| A、标准状况下,1mol CO2和CO的混合气中含有的氧原子数为1.5NA |
| B、常温常压下,11.2L氯化氢气体中含有的分子数为0.5NA |
| C、12g Mg与足量二氧化碳反应转移的电子数为NA |
| D、1mol?L-1 CuCl2溶液中含有的氯离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 它可通过不同化学反应分别制得B、C、D和E四种物质.
它可通过不同化学反应分别制得B、C、D和E四种物质.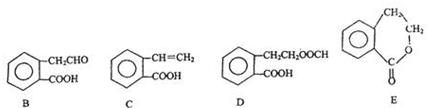
 、HCOOH、CH3COOC2H5
、HCOOH、CH3COOC2H5查看答案和解析>>
科目:高中化学 来源: 题型:

| 时间 | 浓度(mol/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
| v(0min-10min) |
| v(10min-20min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 时间/mim | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大.已知X是迄今为止形成化合物最多的元素.Y原子最外层电子数与核外电子总数之比为3:4.M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物.Z、M、N 同周期,M2-、N-、Z+ 离子半径逐渐减小.W是第Ⅷ族元素中原子序数最小的元素.据此回答:
原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大.已知X是迄今为止形成化合物最多的元素.Y原子最外层电子数与核外电子总数之比为3:4.M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物.Z、M、N 同周期,M2-、N-、Z+ 离子半径逐渐减小.W是第Ⅷ族元素中原子序数最小的元素.据此回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com