
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
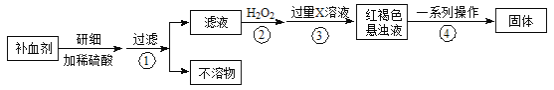
请回答下列问题:
(1)补血剂存放时间较长会氧化变质,对滤液中铁元素的存在形式提出如下假设:
假设1:只有Fe2+
假设2:只有Fe3+
假设3: 。
(2)如何证明步骤①滤液中含有Fe2+ 。
(3)步骤④中一系列处理的操作步骤: 、洗涤、灼烧、 、称量。
(4)该小组有些同学认为可用酸化的KMnO4溶液滴定进行Fe2+含量的测定。
①用离子方程式表示该滴定原理:____________________
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、量筒、药匙、胶头滴管外,还需 。
重复滴定三次,消耗1.00 mol/L KMnO4标准溶液体积分别为19.98 mL、20.00 mL、20.02mL,3次实验所用Fe2+溶液的体积为20.00 mL。请根据以上数据,再设计合理数据,完成下列实验过程的记录表格。(必须填满)
实验编号 | Fe2+溶液的 体积/mL | |||
1 | 20.00 | |||
2 | 20.00 | |||
3 | 20.00 |
③如何判断达到滴定终点:____________________________。
【答案】(1)既有Fe2+又有Fe3+
(2)取少量滤液加入试管中,滴加几滴酸性KMnO4溶液,振荡KMnO4溶液褪色,说明含有Fe2+。
(3)过滤、 冷却
(4)①5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O ②250mL容量瓶
(6分)
实验编号 | Fe2+溶液的体积/mL | 1.00mol/LKMnO4溶液的起始读数/mL | 1.00mol/LKMnO4溶液的终止读数/mL | 消耗1.00mol/LKMnO溶液的体积/mL |
1 | 20.00 | 0.00 | 19.98 | 19.98 |
2 | 20.00 | 0.00 | 20.00 | 20.00 |
3 | 20.00 | 0.00 | 20.02 | 20.02 |
③滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,30秒内不恢复。
【解析】
试题分析:(1)根据题意,只有三种可能,其中的任意一种或两种都有,可得答案;(2)此题考查Fe2+的检验,由于溶液中可能含有Fe3+,进行检验时只能利用Fe2+的还原性,可使酸性KMnO4溶液褪色进行检验;(3)步骤④之前得到的是红褐色的悬浊液,需要过滤获得不溶物,经过灼烧,称量之前需要冷却;(4)①KMnO4具有强氧化性,可以将Fe2+氧化为Fe3+,而自身被还原为Mn2+,根据溶液显酸性,利用电子守恒和电荷守恒配平得下列方程式;5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O②配制KMnO4溶液,需要用到天平、玻璃棒、烧杯、量筒、药匙、胶头滴管、250 mL容量瓶,少了250 mL容量瓶;根据表格所给信息,进行滴定操作时,需要对初始读数、终止读数以及消耗溶液的体积进行记录,所以空格中应为这三项数据,要注意所消耗的体积=(终止读数—初始读数),所以最简单的方法是将初始读数都调节为0.00ml,但也可以其他数据,只需相对应即可;③滴定终点即为恰好完全反应时溶液的变化,用KMnO4滴定Fe2+溶液,应为一开始滴入的KMnO4被消耗完,无色,当Fe2+被消耗完时,再滴入一滴KMnO4,溶液将变为紫色,且30s不褪色,此为滴定终点。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组以乙烯等为主要原料合成药物普鲁卡因:
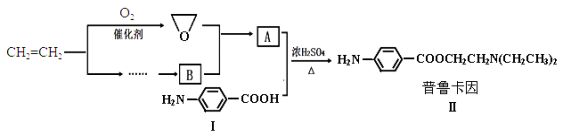
已知:![]()
(1)对于普鲁卡因,下列说法正确的是________。
A.一个分子中有11个碳原子
B.不与氢气发生加成反应
C.可发生水解反应
(2)化合物Ⅰ的分子式为 ,1mol化合物Ⅰ能与 mol H2恰好完全反应。
(3)化合物Ⅰ在浓H2SO4和加热的条件下,自身能反应生成高分子聚合物Ⅲ,写出Ⅲ的结构简式_____。
(4)请用化学反应方程式表示以乙烯为原料制备B(无机试剂任选)的有关反应,并指出所属的反应类型___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用铜和浓硫酸制取SO2,并依次检验SO2具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如下图所示(图中连接胶管、夹持和加热装置省略):
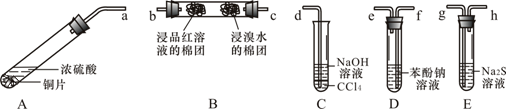
查阅资料可知,HSO3- 的酸性强弱与H2CO3相近。请回答下列问题:
(1)装置A中发生反应的化学方程式是:A
(2)上述装置的接口连接顺序依次是a→ → → → →g→h→d(填导管接口字母)。
(3)证明SO2具有氧化性的现象是 ;证明SO2具有还原性的实验中,反应的离子方程式是 。
(4)C试管中NaOH溶液的作用是 ,CCl4的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯贝特是临床上一种降脂抗血栓药物,其结构如下图所示: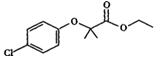 。
。
它的一条合成路线如下:提示:(图中部分反应条件及部分反应物、生成物已略去)
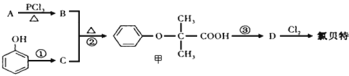
已知:
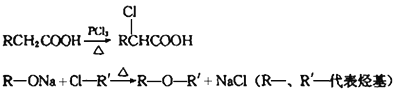
(1)氯贝特的分子式为 ,其中能发生水解反应的官能团名称为 。
(2)A→B的反应类型是 ,B的结构简式是 。
(3)要实现反应①所示的转化,加入下列物质不能达到目的的是 。
a.NaOH b.NaCl c.NaHCO3 d. Na
(4)由D生产的氯贝特的化学方程式为 。
(5)有机物甲有多种同分异构体,则同时满足一下条件的甲的所有同分异构体有种 。
①苯环上有2个取代基;②属于酯类;③既能与FeCl3溶液反应显紫色,又能发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)直接排放煤燃烧产生的烟气会引起严重的环境问题,将烟气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,最终生成硫酸钙。硫酸钙可在下图所示的循环燃烧装置的燃料反应器中与甲烷反应,气体产物分离出水后得到几乎不含杂质的二氧化碳,从而有利于二氧化碳的回收利用,达到减少碳排放的目的。

请回答下列问题:
(1)煤燃烧产生的烟气直接排放到空气中,引发的主要环境问题有________(填字母)。
A.温室效应 B.酸雨
C.粉尘污染 D.水体富营养化
(2)在烟气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
①二氧化碳与石灰石浆液反应得到的产物为_______________(填化学式)。
②亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为____________________。
(II)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(3)联氨分子的电子式为_____________,其中氮的化合价为____________。
(4)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为________________。
(5)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH4
上述反应热效应之间的关系式为ΔH4=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关表示正确的是( )
A.过氧化钙(CaO2)的电子式:![]()
B.某微粒的结构示意简图为![]() ,则该元素在周期表中位于第三周期、VIA族
,则该元素在周期表中位于第三周期、VIA族
C.H2CO3的电离方程式:H2CO32H++CO32﹣
D.葡萄糖的结构简式:C6H12O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
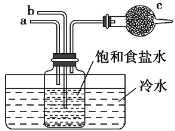
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3,然后a通入CO2,c中放碱石灰
C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等
(1)下列能说明碳、硫两种元素非金属性相对强弱的是 (填序号)
①沸点:H2S>CH4
②酸性:H2SO3>H2CO3
③CS2中碳元素为+4价,硫元素为﹣2价
(2)羰基硫(COS)可作为一种熏蒸剂,其分子结构和CO2相似.羰基硫(COS)的电子式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com