
 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | NO | NO2 | HNO3 |
| C | Si | SiO2 | H2SiO3 |
| D | FeS2 | SO2 | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氢氧化铝首先转化为氧化铝,氧化铝电解得到铝单质;
B.NO与氧气反应得到二氧化氮,二氧化氮与水反应生成硝酸与NO,浓硝酸与铜反应生成二氧化氮,稀硝酸与铜反应生成NO;
C.二氧化硅需先到硅酸钠,硅酸钠与酸反应得到硅酸;
D.H2SO4不能一步生成FeS2.
解答 解:A.Al(OH)3→Al的转化,应首先转化为氧化铝,再电解氧化铝得到铝单质,故A错误;
B.NO与氧气反应得到二氧化氮,二氧化氮与水反应生成硝酸与NO,浓硝酸与铜反应生成二氧化氮,稀硝酸与铜反应生成NO,故B正确;
C.二氧化硅到硅酸的转化,应先与氢氧化钠反应生成硅酸钠,硅酸钠与酸反应得到硅酸,故C错误;
D.FeS2与氧气高温生成SO2,SO2再被氧化生成H2SO4,H2SO4与铜反应生成二氧化硫,但H2SO4不能一步生成FeS2,故D错误;
故选B.
点评 本题考查元素化合物知识,题目难度中等,旨在考查学生对基础知识的理解掌握,学习中基础知识的积累.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | Ⅰ和Ⅱ中正级均被保护 | |
| B. | Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ | |
| C. | Ⅰ和Ⅱ中正级反应均是O2+2H2O+4e-=4OH- | |
| D. | Ⅰ和Ⅱ中均有Fe2+生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑥ | C. | ①②⑤ | D. | ①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
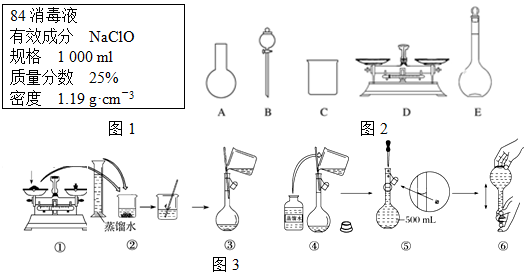
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Cu═2FeCl2+CuCl2
现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Cu═2FeCl2+CuCl2查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2O═H++OH- | B. | NaHSO4═Na++HSO4- | ||
| C. | NaHS═Na++HS- | D. | HCO3-═H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| B. | 图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合,转化成Cr(OH)3除去 | |
| C. | 图乙电解池中,若有0.84 g阳极材料参与反应,则阴极会有168 mL(标准状况)的气体产生 | |
| D. | 若图甲燃料电池消耗0.36 g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com