
| A. | 开始时A容器中的反应速率大于B容器中的反应速率 | |
| B. | 平衡时c(I2)A=c(I2)B | |
| C. | HI的平衡分解率:αA>αB | |
| D. | 平衡时,I2蒸气在混合气体中的体积分数:A容器>B容器 |
分析 容器A中HI的浓度大于容器B,则A中开始反应速率快,由于A容器中浓度大,故A的压强比B中大,A等效为B平衡的基础上增大压强,由于反应前后气体条件不变,增大压强平衡不移动,则HI的转化率不变,相同物质的含量相同.
解答 解:由于A容器中浓度大,故A的压强比B中大,A等效为B平衡的基础上增大压强,由于反应前后气体条件不变,增大压强平衡不移动,则HI的转化率不变,相同物质的含量相同.
A.容器A中HI的浓度大于容器B,则A中开始反应速率快,故A正确;
B.两容器中平衡时HI的转化率相同,则平衡时c(I2)A>c(I2)B,故B错误;
C.由上述分析可知,HI的平衡分解率:αA=αB,故C错误;
D.容器A、B中平衡为等效平衡,平衡时I2蒸气在混合气体中的体积分数相等,故D错误,
故选:A.
点评 本题考查化学平衡计算与影响因素,涉及等效平衡问题,较好的考查学生分析解决问题能力,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;肼含有的化学键的种类与过氧化氢中完全一样,由此可以推论肼的结构式为
;肼含有的化学键的种类与过氧化氢中完全一样,由此可以推论肼的结构式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸跟强碱的反应热一定是中和热 | |
| B. | 1molC完全燃烧放热383.3kJ,其热化学方程为:C+O2═CO2 △H=-383.3kJ•mol-1 | |
| C. | 在稀溶液中,酸与碱发生中和反应生成1mol H2O时的反应热叫做中和热 | |
| D. | 表示中和热的离子方程式为:H+(aq)+OH-(aq)═H2O(l);△H=57.3KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa 下,将0.5 mol N2 和 1.5 mol H2 置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知在120℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+$\frac{1}{2}$O2(g)$\frac{\underline{\;\;\;120℃\;\;\;}}{101kPa}$H2O(g)△H=-242 kJ/mol | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+283.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量: N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=+642 kJ•mol-1 | |
| B. | 12 g石墨转化为CO时,放出110.5 kJ的热量: 2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ•mol-1 | |
| C. | 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286 kJ•mol-1, 则:2H2O(l)═2H2(g)+O2(g)的△H=+572 kJ•mol-1 | |
| D. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
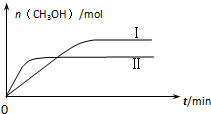 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
| 电离平衡常数 | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 | 1.8×l0-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com