
某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如下图所示:

(1)碱浸时为提高铝土矿的浸出率可采取的措施是 , 。(答两点)
(2)AlO(OH)与NaOH反应的化学方程式为 。
(3)在稀释、结晶过程中,加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的某气体的方法来代替。通入气体时发生反应的离子方程式是 .
(4)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式: 。
(5)该生产流程能实现 (填化学式)的循环利用。
(6)氧化铝是工业上冶炼铝的原料,用氧化铝电解制备金属铝时需加入冰晶石(Na3AlF6)作助熔剂,写出用NaF和Al2(SO4)3反应制备冰晶石的化学方程式为 。
(1)粉碎铝土矿,升高温度(其他合理答案也给分)
(2)AlO(OH) +NaOH=NaAlO2+H2O
(3)AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓
(4)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(5)NaOH
(6)12NaF+Al2(SO4)3====2Na3AlF6+3Na2SO4
【解析】
试题分析:(1)升高温度、增大反应物的接触面积能加快反应速率,碱浸时为提高铝土矿的浸出率可采取的措施粉碎铝土矿,升高温度;(2)AlO(OH)与NaOH反应生成偏铝酸钠和水,化学方程式为AlO(OH) +NaOH=NaAlO2+H2O;(3)根据题给流程分析,该过程是通过NaAlO2的稀释生成Al(OH)3,没有其它反应物,氢氧化铝是水解产生,稀释促进NaAlO2的水解,也可以用足量CO2与NaAlO2反应生成氢氧化铝沉淀和碳酸氢钠,离子方程式为AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;(4)加入熟石灰,氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;(5)NaOH碱浸时使用,最后过滤时产生,故是循环利用;(4)NaF和Al2(SO4)3反应生成Na3AlF6和Na2SO4,化学方程式为12NaF+Al2(SO4)3====2Na3AlF6+3Na2SO4。
考点:考查化学工艺流程原理有关问题。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届广东省湛江市毕业班调研测试理综化学试卷(解析版) 题型:选择题
常温下,0.1 mol·L-1的一元酸HA与0.1 mol·L-1的NaOH溶液等体积混合后,所得溶液pH>7, 下列说法正确的是
A.混合前一元酸HA的c(H+)=0.1 mol·L-1
B.该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
C.HA在水溶液中的电离方程式:HA = H+ + A-
D.该混合溶液中:c(A-)+ c(HA)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015届江苏省盐城市、建湖二中高一上学期期中联考化学试卷(解析版) 题型:填空题
(10分)某化学探究学习小组同学在实验室中配制100mL 0.5mol/L的Na2CO3溶液。
(1)下列实验步骤是配制溶液所必需的步骤,请使用各步骤的编号按照实验操作时的顺序进行排序(填写各步骤的编号)_______________________;
①溶解 ②定容 ③计算 ④转移 ⑤称量 ⑥洗涤并转移 ⑦反复倒转摇匀
(2)实验中除了需要天平、药匙、烧杯、玻璃棒外,还需要的仪器有_______________;
(3)用碳酸钠晶体(Na2CO3·10H2O)配制该溶液需要 g,若称取等质量的Na2CO3 ,则所配制溶液的浓度 (填写偏高、偏低、无影响);
(4)该小组在实验室中发现了一张注射用质量分数为5%的葡萄糖(分子式为C6H12O6,相对分子质量为180)溶液的标签,如下图所示:

该溶液的物质的量浓度为________(小数点后保留2位数)。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省盐城市、建湖二中高一上学期期中联考化学试卷(解析版) 题型:选择题
工业上铁的冶炼是在炼铁高炉中进行的,发生的反应是 Fe2O3+3CO=2Fe+3CO2,此反应属于
A、化合反应 B、氧化还原反应 C、置换反应 D、分解反应
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:填空题
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为 。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)写出与BD2互为等电子体的C3-的结构式 。
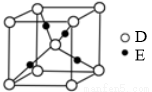
(4)E+的核外电子排布式为 ,下图是D、E形成的某种化合物的晶胞结构示意图,该晶体1个晶胞中阳离子的个数为 。
(5)向E的硫酸盐溶液中通入过量的CA3,可生成[E(CA3)4]2+配离子,1 mol [E(CA3)4]2+中含有σ键的数目为 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连
B.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C.一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0
D.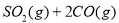

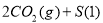 达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高
达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
下列有关物质应用的说法不正确的是
A.氯气用于制备漂白粉
B.单质硅用于制造光导纤维
C.氧化铝的熔点很高,可用于制作耐高温材料
D.三氧化二铁用于生产红色颜料
查看答案和解析>>
科目:高中化学 来源:2015届江苏省、常州一中、沭阳中学高三联合调研化学试卷(解析版) 题型:选择题
强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:
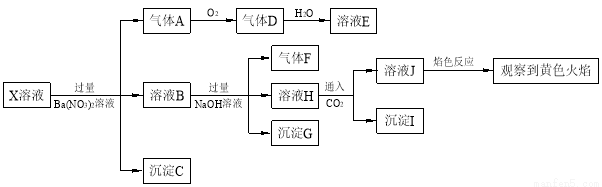
下列结论正确的是
A.X中肯定存在Na+、Fe2+、A13+、NH4+、SO42-
B.气体F经催化氧化可直接生成气体D
C.沉淀C一定是BaSO4、 沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3
D.X中不能确定的离子是 A13+、Na+、K+和C1-
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:选择题
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是
A.CaO2具有氧化性,对面粉可能具有增白作用
B.CaO2中阴阳离子的个数比为1:1
C.CaO2和水反应时,每产生1 mol O2转移电子4 mol
D.CaO2和CO2反应的化学方程式为:2CaO2 +2CO2 =2CaCO3+O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com