
分析 常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红可知,C为O元素,D为Na元素;B的最外层电子数比C的最外层电子数少1个,则B的最外层电子数为5,与氧元素同周期,则B应为N元素;C与E同主族,E应为S元素,A与氧元素同周期,A与C的最外层电子数之比2:3,则A的最外层电子数为4,应为C元素,根据元素所在周期表中的位置结合元素周期律的递变规律以及对应化合物的结构和性质解答该题.
解答 解:(1)常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红,可知C为O元素,D为Na元素;B的最外层电子数比C的最外层电子数少1个,则B的最外层电子数为5,与氧元素同周期,则B应为N元素;C与E同主族,E应为S元素,A与氧元素同周期,A与C的最外层电子数之比2:3,则A的最外层电子数为4,应为C元素,
根据分析可知,A、B、C、D、E分别为:C、N、O、Na、S,C、D的名称为氧、钠,
故答案为:C;N;O;氧;钠;
(2)E为S元素,原子序数为16,核外有3个电子层,最外层电子数为6,位于周期表第三周期VIA族,
故答案为:三;VIA;
(3)B为N元素,其氢化物为氨气,其最高价氧化物的水化物为硝酸,氨气与硝酸反应生成NH4N03,
故答案为:NH4N03;
(4)化合物D2C2为过氧化钠,过氧化钠与水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(5)铜与稀硝酸反应生成硝酸铜、一氧化氮气体和水,反应离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
点评 本题考查结构性质位置关系,题目难度中等,推断元素是解题关键,过氧化钠的性质是解答本题的突破口,注意掌握原子结构与元素周期律、元素周期表的结构,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,17 g甲基(-14CH3)所含的中子数为8NA | |
| B. | 0.1 mol Fe与0.1 mol Cl2充分反应,转移的电子数为0.2NA | |
| C. | 标准状况下,44.8 L NO与22.4 L O2混合后气体的分子总数为2NA | |
| D. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮化硅陶瓷是新型无机非金属材料 | B. | 普通玻璃、有机玻璃都属于硅酸盐 | ||
| C. | 纤维素乙酸酯属于天然高分子材料 | D. | 单晶硅常用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NH4+、CO32-、Br- | B. | Fe2+、H+、NO3-、Cl- | ||
| C. | Al3+、Ca2+、HCO3-、SO42- | D. | Fe3+、Cu2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某溶液与稀盐酸反应产生的气体通入澄清石灰水 | 石灰水变浑浊 | 该溶液中一定含有CO32- |
| B | 常温下,将铁片浸入足量浓硫酸中 | 铁片不溶解 | 常温下,铁与浓硫酸一定没有发生化学反应 |
| C | 向某食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该食盐中一定没有添加KIO3 |
| D | 向Na2SiO3溶液中滴加乙酸溶液 | 溶液变浑浊 | 相同条件下,乙酸的酸性一定比硅酸强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
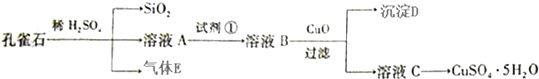
 .
.
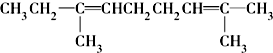 .
.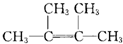 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 一定温度下,在容积为VL的密闭容器中进行反应:aN(g)═bM(g),M、N的物质的量随时间的变化曲线如图所示.
一定温度下,在容积为VL的密闭容器中进行反应:aN(g)═bM(g),M、N的物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入淀粉,溶液变蓝色,则溶液中含有I- | |
| B. | 向无色溶液中加入BaCl2溶液有白色沉淀产生,则溶液中含有SO42- | |
| C. | 利用蛋白质的颜色反应可以鉴别所有的蛋白质 | |
| D. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中含有Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com