
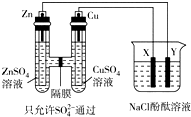
 按如图所示装置连接,X、Y均为惰性电极.常温下,当Zn极质量减少3.25g时,X极生成气体840mL(标准状况),若此时烧杯中溶液的体积为500mL,则此时烧杯中溶液的pH(不考虑生成气体溶于水及与溶液的反应)( )
按如图所示装置连接,X、Y均为惰性电极.常温下,当Zn极质量减少3.25g时,X极生成气体840mL(标准状况),若此时烧杯中溶液的体积为500mL,则此时烧杯中溶液的pH(不考虑生成气体溶于水及与溶液的反应)( )| A. | 11 | B. | 12 | C. | 13 | D. | 14 |
分析 左侧装置为原电池,锌为负极,被氧化,Cu为正极,右侧装置为电解池,X为阳极,发生氧化反应,生成氯气,Y为阴极,发生还原反应,生成氢气和氢氧化钠,结合电极方程式解答该题.
解答 解:n(Zn)=$\frac{3.25g}{65g/mol}$=0.05mol,则转移0.1mol电子,
如果全部生成氯气则有0.05 mol氯气生成,如果全部生成氧气,则有0.025 mol氧气生成,
而X极生成气体的物质的量为$\frac{0.84L}{22.4L/mol}$=0.0375mol,说明生成气体为氯气和氧气的混合物,
设生成xmol氯气,ymol氧气,
则$\left\{\begin{array}{l}{x+y=0.0375}\\{2x+4y=0.1}\end{array}\right.$,
解得:x=0.025,y=0.0125,
由2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,可知生成0.05molNaOH,则c(OH-)=$\frac{0.05mol}{0.5L}$=0.1 mol/L,pH=13,
故答案为:13.
点评 本题考查原电池和电解池原理,为高频考点,题目难度中等,试题侧重于学生的分析能力和计算能力的考查,注意把握原电池和电解池的工作原理.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:多选题
| A. | 铁制容器可盛装冷的浓硫酸,因为常温下铁和浓硫酸不反应 | |
| B. | Na2O2用作呼吸面具的供氧剂 | |
| C. | 欲鉴别FeCl2溶液、AlCl3溶液和AgNO3溶液,向3种待测液中分别滴加足量氨水 | |
| D. | 铝热反应需提供一定的能量引发,因为铝热反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
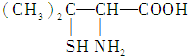
| A. | 青霉氨基酸分子中所有碳原子均在同一直线上 | |
| B. | 青霉氨基酸具有两性并能发生酯化反应 | |
| C. | 青霉氨基酸分子间不能发生缩合反应 | |
| D. | 1 mol青霉氨基酸与足量的金属钠反应生成0.5 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
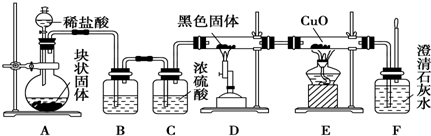
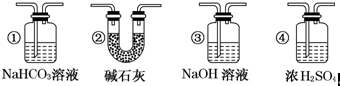
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制氧气时,用Na2O2或H2O2作反应物应该选择不同的气体发生装置 | |
| B. | 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- | |
| C. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀时的离子方程式为:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com