
元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分,回答下列有关问题: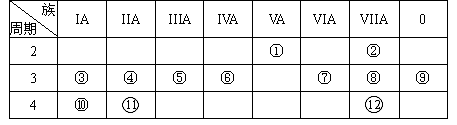
(1)写出下列元素符号:① ,⑥ ,⑦ 。
(2)画出原子的结构示意图:④ ,⑤ ,⑧ 。
(3)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 ,最不活泼的元素是 。(均填元素符号)
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。
(5)在③与④中,化学性质较活泼的是 (填元素符号),怎样用化学实验证明:
答: (该空2分,其余每空1分)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D四种短周期元素,A元素有三个电子层,其中最外层电子数占总电子数的1/6;B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请填写下列空格:
(1)请写出A的元素符号 ;
(2)C的一价阴离子的结构示意图 ;
B的原子的结构示意图 ;
(3)A、B两元素相比较,A元素的金属性较强,可以验证该结论的实验是( )。
A.将这两种元素的块状单质分别放入冷水中
B.将这两种元素的单质分别和同浓度的盐酸反应
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞试液
D.比较这两种元素的气态氢化物的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4:1形成化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙可与Z的最高价氧化物的水化物按照物质的量之比2:1反应形成盐丙。
(1)甲的电子式是 。
(2)Q和Y形成的既含极性键又含非极性键的共价化合物的化学式是 。
(3)向少量丙溶液中加入浓Ba(OH)2溶液至过量并加热,反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期;B原子最外层电子数是次外层的两倍;在周期表中A的原子半径最小;C是地壳中含量最多的元素,C是F不同周期的邻族元素;E和F的原子序数之和为30。由上述六种元素中的几种元素组成的甲、乙、丙、丁、戊、己六种化合物如下表所示:
元素形成的化合物
| 化合物 | 甲 | 乙 | 丙 |
| 各元素原子 个数比 | N(A):N(C) =2:1 | N(A):N(C) =1:1 | N(B):N(A) =1:4 |
| 化合物 | 丁 | 戊 | 己 |
| 各元素原子 个数比 | N(D):N(B):N(C) =2:1:3 | N(E):N(F) =1:3 | N(B):N(F) =1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E
分别同主族,D、E、F同周期。A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C可形成电子总数相等的分子,且A与C、A与E、A与F也可以形成电子总数相等的分子。
请回答下列问题:
(1)元素F在周期表中的位置________________________________________________。
(2)A、C、D三种元素可组成一种常见化合物,该化合物的化学式为________;工业生产该化合物和单质F的离子方程式为_________________________________________。
(3)B与F形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为________________________________________________________________________。
(4)已知0.50 mol EC2被C2氧化成气态EC3,放出49.15 kJ热量,其热化学方程式为_________________________________________________________________________。
(5)A、B、C以原子个数比4∶2∶3所形成的化合物,所含的化学键类型为____________。
0.1 mol·L-1该化合物水溶液中的离子浓度由大到小的顺序为_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、0四种元素的电负性由小到大的顺序为_____________________。
②下列叙述不正确的是_____________。(填字母)
A.因为HCHO与水分子间能形成氢键,所以HCHO易溶于水
B.HCHO和CO2分子中的中心原子均采用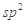 杂化
杂化
C.C6H6分子中含有6个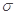 键和1个大
键和1个大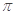 键,C2H2是非极性分子
键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是__________。
②六氰合亚铁离子[Fe(CN)6]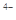 中不存在______________________________________。
中不存在______________________________________。
A.共价键 B.非极性键 C.配位键 D.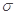 键 E.
键 E.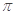 键
键
写出一种与CN-互为等电子体粒子的分子式_____________________。
(3) SO3分子的立体构型为_____________,SeO32-的立体构型为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
| 元素代号 | 相关信息 |
| X | 它的一种核素的原子核内没有中子 |
| Y | 能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
| Z | 基态原子的最外层电子排布式为nsnnpn+1 |
| W | 与钠元素能组成两种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
| T | 主要化合价有+1和+2价,其二价离子在水溶液中呈蓝色 |
 YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol
YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有5种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)用电子式表示离子化合物A2B的形成过程:__________________________________________________________________________。
(2)写出下列物质的电子式:
D元素形成的单质__________;B与E形成的化合物E2B__________;A、B、E形成的化合物__________;D、E形成的化合物__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com