
| A. | 溶液中含有的阴、阳离子总数为共0.6 mol | |
| B. | 在0.5L该溶液中,Ba2+的浓度为0.1 mol/L | |
| C. | 在500 mL该溶液中,含有0.2 mol NO3- | |
| D. | 取1L该溶液稀释到10L时,NO3-的浓度为0.2 mol/L |
分析 A、体积不知物质的量无法求;
B、离子的浓度与体积无关;
C、在500 mL该溶液中,硝酸钡的物质的量为0.1mol;
D、取1L该溶液稀释到10L时,微粒浓度是原来浓度的$\frac{1}{10}$;
解答 解:A、体积不知物质的量无法求,所以阴、阳离子总数无法求,故A错误;
B、离子的浓度与体积无关,则Ba2+的浓度为0.2 mol/L,故B错误;
C、在500 mL该溶液中,硝酸钡的物质的量为0.1mol,所以含有0.2 mol NO3-,故C正确;
D、取1L该溶液稀释到10L时,微粒浓度是原来浓度的$\frac{1}{10}$,所以NO3-的浓度为0.04 mol/L,故D错误;
故选C.
点评 本题考查了物质的量浓度的相关计算,题目难度不大,试题侧重基础知识的考查,注意掌握物质的量浓度的概念及计算方法,明确溶液具有均一性,浓度与溶液体积大小无关.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl溶液 | B. | 稀H2SO4溶液 | ||
| C. | 饱和FeCl3溶液 | D. | 饱和氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述生成Ni(CO)4(g)的反应为吸热反应 | |
| B. | 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 | |
| C. | 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v正<v逆 | |
| D. | 恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠投入到氯化镁溶液中:2Na+Mg2+═Mg+2 Na+ | |
| B. | 把金属钠放入水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 将氯水加入碘化钾溶液中:Cl2+2I-═2Cl-+I2 | |
| D. | 盐酸滴在石灰石上:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液与石灰乳的反应:CO32-+Ca 2+=CaCO3↓ | |
| B. | 硝酸银溶液与食盐水的反:Ag++Cl-=AgCl↓ | |
| C. | 锌与盐酸的反应:Zn+2H++2Cl -=Zn 2++2Cl-+H2↑ | |
| D. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe 3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
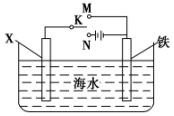 利用如图装置,可以模拟铁的电化学防护.
利用如图装置,可以模拟铁的电化学防护.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com