
分析 (1)①燃烧热是在101KP时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,C元素要转化为二氧化碳,H元素要转化为液态水,已知H2和CH2OCH3的燃烧热分别为285.8kJ/mol和1455.0kJ/mol,且H2O(l)=H2O(g)△H=+44.0kJ/mol,分别写出热化学方程式,然后根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式;
②当一个量在反应未平衡的时候一直在变化,而后来不变了,则可以作为平衡的标志,即变量不变分析;
(2)①结合化学平衡三行计算列式得到,气体压强之比一定条件下为气体物质的量之比,转化率=$\frac{消耗量}{起始量}$×100%,计算此温度下平衡常数,若在上述平衡体系中再充入1 molCO2和1 mol H2O(g),计算难度商和平衡常数比较判断反应进行的方向,已知在T2℃下,上述反应的平衡常数为1,比较平衡常数判断温度高低;
②若既能提高CO2的转化率,平衡正向进行,又能加快反应速率,结合影响化学反应速率的因素判断;
(3)用惰性电极电解饱和草酸溶液,草酸在阴极放电,C由+3价降到+1价,得到2个电子,电极反应式为HOOC-COOH+2e-+2H+=OHC-COOH+H2O;
(4)将0.02mol•L-1澄清石灰水和0.01mol•L-1H2C2O4溶液等体积混合,c(Ca2+)=0.01mol•L-1,根据CaC2O4的Ksp为2.5×10-9,所得溶液中C2O42-的物质的量浓度为$\frac{Ksp}{c(C{a}^{2+})}$=$\frac{2.5×1{0}^{-9}}{0.01}$=2.5×10-7mol•L-1.
解答 解:(1)①燃烧热是在101KP时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,C元素要转化为二氧化碳,H元素要转化为液态水.
已知H2和CH2OCH3的燃烧热分别为285.8kJ/mol和1455.0kJ/mol,且H2O(l)=H2O(g)△H=+44.0kJ/mol,分别写出热化学方程式:
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol I,
CH3OCH3(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1455.0kJ/molⅡ,
H2O(l)=H2O(g)△H=+44.0kJ/molⅢ,
盖斯定律计算得到CO2和H2反应生成二甲醚和水蒸气的热化学方程式:6H2(g)+2CO2(g)=CH3OCH3(l)+3H2O(g)△H=-127.8KJ/mol,
故答案为:6H2(g)+2CO2(g)=CH3OCH3(l)+3H2O(g)△H=-127.8kJ/mol;
②对于反应:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O (g)
a.此反应全部是气体参加和生成,故气体的质量一直不变,而正反应方向是气体的物质的量减小的反应,故平衡之前,气体平均相对分子质量在变大,故当不变时,能说明反应达平衡,故a正确;
b.由于是恒容的容器,容器体积V一直不变,而此反应全部是气体参加和生成,故气体的质量一直不变,则气体的密度无论反应有没有达到平衡都一直不变,故不能作为反应达平衡的标志,故b错误;
c.反应前n(C02)=2mol,n(H2)=6mol,而根据物质的量的该变量等于计量数之比可知,△(C02):△(H2)=2:6,故无论反应是否达到平衡,n(C02):n(H2)恒等于2:6即1:3,故当比值不变时,不能说明反应达平衡,故c错误;
d.速率之比等于化学方程式计量数之比,v正(CO2)=2v逆(CH3OCH3)说明二甲醚正逆反应速率相同,反应达到平衡,故d正确;
故选ad,
故答案为:ad;
(2)①在T1℃下,向3L容器中充入2 molCO2和6 molH2,设消耗二氧化碳物质的量为x,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol) 2 6 0 0
变化量(mol) x 3x x x
平衡量(mol)2-x 6-3x x x
测得平衡时容器内压强是起始压强的$\frac{3}{4}$,
$\frac{2-x+6-3x+x+x}{2+6}$=$\frac{3}{4}$
x=1
则CO2的转化率=$\frac{1}{2}$×100%=50%,
平衡常数K=$\frac{\frac{1}{3}×\frac{1}{3}}{\frac{1}{3}×(\frac{3}{3})^{3}}$=$\frac{1}{3}$,
若在上述平衡体系中再充入1 molCO2和1 mol H2O(g),此时浓度商Qc=$\frac{\frac{2}{3}×\frac{1}{3}}{\frac{2}{3}×(\frac{3}{3})^{3}}$=$\frac{1}{3}$=K,则此时v正=v逆,
已知在T2℃下,上述反应的平衡常数为1,平衡常数随温度升高逆向进行则T1>T2,
故答案为:50%;=;>;
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49kJ/mol,
a.升高温度,反应速率增大,平衡逆向进行,二氧化碳转化率减小,故a错误;
b.增大CO2浓度,反应速率增大,二氧化碳转化率减小,故b错误;
c.增大压强反应速率增大,平衡正向进行,二氧化碳转化率增大,故c正确;
d.分离出甲醇,反应速率减小,二氧化碳转化率增大,故d错误;
故答案为:c;
(3)用惰性电极电解饱和草酸溶液,草酸在阴极放电,C由+3价降到+1价,得到2个电子,电极反应式为HOOC-COOH+2e-+2H+=OHC-COOH+H2O;
故答案为:HOOC-COOH+2e-+2H+=OHC-COOH+H2O;
(4)将0.02mol•L-1澄清石灰水和0.01mol•L-1H2C2O4溶液等体积混合,c(Ca2+)=0.01mol•L-1,根据CaC2O4的Ksp为2.5×10-9,所得溶液中C2O42-的物质的量浓度为$\frac{Ksp}{c(C{a}^{2+})}$=$\frac{2.5×1{0}^{-9}}{0.01}$=2.5×10-7mol•L-1.
故答案为:2.5×10-7mol•L-1;
点评 本题考查了盖斯定律的应用、反应达平衡的判断以及平衡常数的有关计算等问题,综合性较强,是高考的常见题型,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | F原子结构示意图: | B. | 次氯酸电子式H Cl O | ||
| C. | H、D、T表示同一种核素 | D. | CO2的结构式为O═C═O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 实验操作 | 现象或结论 |
| ① | 测饱和NaHCO3溶液的pH | pH为8.3 |
| ② | 向2mL Na2CO3溶液中加入MgCl2溶液 | 有白色沉淀生成 |
| ③ | 向2mL饱和NaHCO3溶液中加入MgCl2溶液 | 无明显现象 |
| ④ | 向20mL 饱和NaHCO3溶液中加入少量的NaHCO3固体,静置24小时 | 溶液中微小的气体缓慢地从底部固体逸出,最终固体全部溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期主族元素R、X、Y、Z、M的原子序数依次增太,它们占据三个周期.Y和M位于同主族,Y原子的最外层电子数是电子层数的3倍.这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向溶液中滴加氢氧化钠稀溶液,产生沉淀的物质的量与加入氢氧化钠溶液的体积的关系如图所示.下列说法不正确的是( )
短周期主族元素R、X、Y、Z、M的原子序数依次增太,它们占据三个周期.Y和M位于同主族,Y原子的最外层电子数是电子层数的3倍.这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向溶液中滴加氢氧化钠稀溶液,产生沉淀的物质的量与加入氢氧化钠溶液的体积的关系如图所示.下列说法不正确的是( )| A. | 简单的离子半径:M>Y>Z | |
| B. | 气态氢化物的热稳定性:Y>X | |
| C. | 最高价氧化物对应水化物的酸性:M>Z | |
| D. | 由R、X、Y、M四种元素只能组成一种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
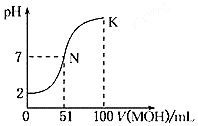 常温下,向100mL0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化勿略不计).下列说法中正确的是( )
常温下,向100mL0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化勿略不计).下列说法中正确的是( )| A. | 该滴定过程可选择酚酞作为指示剂 | |
| B. | HA的电离方程式为:HA?H++A- | |
| C. | K点溶液中:c (MOH)+c(OH-)-c(H+)=0.01mol•L-1 | |
| D. | N点水的电离程度大于K点水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;A、C、D形成的化合物
;A、C、D形成的化合物 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com