2013������������������Ű�ҹ��ж������������У�����β����ȼúβ������ɿ�����Ⱦ��ԭ��֮һ��
��1������β����������Ҫԭ��Ϊ��2NO��g��+2CO��g��
2CO
2��g��+N
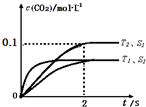
2��g�������ܱ������з����÷�Ӧʱ��c��CO
2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯���ߣ���ͼ1��ʾ��
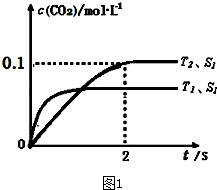
�ݴ��жϣ�
�ٸ÷�Ӧ�ġ�H
0 ��ѡ�����������������
����T
2�¶��£�0��2s�ڵ�ƽ����Ӧ���ʦԣ�N
2��=
��
�۵��������������һ��ʱ�����������������ѧ��Ӧ���ʣ��������ı����
S
1��S
2������ͼ�л���c��CO
2����T
1��S
2 �����´ﵽƽ������еı仯���ߣ�
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t
1ʱ�̴ﵽƽ��״̬����
������ţ���
��2��ֱ���ŷ�úȼ�ղ������������������صĻ������⣮
��úȼ�ղ���������������������������N
2H
4��ȼ�ϣ�N
2O
4������������֪��
N
2��g��+2O
2��g��=2NO
2��g����H=+67.7kJ?mol
-1N
2H
4��g��+O
2��g��=N
2��g��+2H
2O��g����H=-534.0kJ?mol
-1NO
2��g��
N
2O
4��g����H=-26.35kJ?mol
-1��д����̬��������̬������������ȼ�����ɵ�������̬ˮ���Ȼ�ѧ����ʽ��
��
�����Ṥҵ�����е�β�����ô�����Һ���գ��йصĻ�ѧ��ӦΪ��
2NO
2+Na
2CO
3=NaNO
2+NaNO
3+CO
2��NO+NO
2+Na
2CO
3=2NaNO
2+CO
2��
���ڱ�״������NO��NO
2�Ļ�����壨������N
2O
4��ǡ����50mL 1.0mol?L
-1��Na
2CO
3��Һ��Ӧ��ȫ��������NaNO
2��NaNO
3�����ʵ����ı�Ϊ4��1�����ڻ��������NO������������Ϊ���٣�����д��������̣�



 ��
��

 ����˼ά�żӿ���ϵ�д�
����˼ά�żӿ���ϵ�д� �����Ծ�ϵ�д�
�����Ծ�ϵ�д�