
����Ŀ�����к͵ζ����ⶨ�ռ�Ĵ��ȣ��ռ��е����ʲ����ᷴӦ���������ʵ��ش�
��1���������õ�8.8g�ռ���Ʒ���Ƴ�500mL����Һ�����ƹ���ʹ�õ���Ҫ������500mL����ƿ����Ͳ���ձ�����ͷ�ι��⣬����һ�ֱ���ʹ�õ������� ��
��2����ʽ�ζ�����ȡ10.00mL����Һ����ƿ�У����뼸�η�̪��
��3����0.20molL��1�ı�����ζ�����Һ���жϵζ��յ�������ǣ� ��
��4�����ʵ�������ȷ���ӵζ���ʼ����������Һ�е�����Ũ�ȹ�ϵ���Գ��ֵ����������ĸ��ţ�
A.c��Na+����c��Cl������c��H+����c��OH����
B.c��Na+����c��OH������c��Cl������c��H+��
C.c��Na+��+c��H+��=c��OH����+c��Cl����
D.c��Cl����+c��Na+����c��OH����+c��H+��
��5�������������ݼ��㣬c��NaOH�� mol/L
�ζ����� | ����Һ�����mL�� | �����������mL�� | |
�ζ�ǰ������mL�� | �ζ��������mL�� | ||
��һ�� | 10.00 | 0.60 | 20.50 |
�ڶ��� | 10.00 | 3.00 | 23.10 |
��6�������������֣�����ʵ��IJⶨ������ռ��ʵ�ʴ���ƫ�ߣ�������Ŀ���ԭ����
A.�ζ�ǰƽ�ӣ��ζ�����
B.δ�ñ�Һ��ϴ�ζ���
C.�ô���Һ��ϴ��ƿ
D.��С�Ľ���Һ������ƿ���森
���𰸡�
��1��������
��2����
��3�����������һ�����ᣬ��Һ�ɺ�ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ
��4��B,C
��5��0.40
��6��B,C,D
���������⣺��1.�����Ʋ����м��㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ����������ƽ��������ҩ��ȡ��ҩƷ�����ձ����ܽ⣨������Ͳ��ȡ������ȴ��ת�Ƶ�250mL����ƿ�У����ò���������������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ��������������Ҫ250mL����ƿ����Ͳ���ձ�����ͷ�ι��⣬����һ�ֱ���ʹ�õ������Dz����������Դ��ǣ���������
��2.���ռ��Լ��ԣ�����Ҫ�ü�ʽ�ζ�����ȡ�ռ���Һ�����Դ��ǣ��
��3.���ζ�ǰ��ҺΪ��ɫ���ζ��յ�ʱ��ҺΪ��ɫ�����Եζ��յ�����Ϊ�����һ����Һ�ɺ�ɫ��Ϊ��ɫ������Ӳ���ɫ�����Դ��ǣ����������һ�����ᣬ��Һ�ɺ�ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ��
��4.��A����c��Na+����c��Cl������c��H+����c��OH������������c��Na+��+c��H+����c��Cl����+c��OH��������������Һ����ڵĵ��ʽc��Na+��+c��H+��=c��OH����+c��Cl������������A����
B����NaOH��Һֻ�μӼ���ϡ���ᣬ��ʱ��Һֻ��������NaCl��Ӧ�ô��ڣ�c��Na+����c��OH������c��Cl������c��H+������B��ȷ��
C����Һʼ�������ԣ����ڵ���غ�ʽ��c��Na+��+c��H+��=c��OH����+c��Cl��������C��ȷ��
D��c��Na+��+c��H+����c��OH����+c��Cl��������Һ����ڵĵ��ʽc��Na+��+c��H+��=c��OH����+c��Cl������������D����
��ѡBC��
��5.�����������Һ������ֱ�Ϊ��19.90mL��20.10mL���������ݾ���Ч�������Һ��ƽ�����Ϊ20.00mL��
HCl | �� | NaOH |
1 | 1 | |
0.2000mol/L��20.00mL | c��NaOH����10mL |
��ã�c��NaOH��=0.4mol/L��
���Դ��ǣ�0.40��
��6.��A���ζ�ǰƽ�ӣ��ζ����ӣ����V������ƫС������c�����⣩= ![]() ��������֪c�����⣩ƫС���ռ��ƫС����A����
��������֪c�����⣩ƫС���ռ��ƫС����A����
B��δ�ñ�Һ��ϴ�ζ��ܣ���ҺŨ�ȼ�С�����V������ƫ����c�����⣩= ![]() ��������֪c�����⣩ƫ���ռ��ƫ��B��ȷ��
��������֪c�����⣩ƫ���ռ��ƫ��B��ȷ��
C���ô���Һ��ϴ��ƿ������Һ�����ʵ���ƫ�����V������ƫ����c�����⣩= ![]() ��������֪c�����⣩ƫ���ռ��ƫ��C��ȷ��
��������֪c�����⣩ƫ���ռ��ƫ��C��ȷ��
D����С�Ľ���Һ������ƿ���棬���V������ƫ����c�����⣩= ![]() ��������֪c�����⣩ƫ���ռ��ƫ��D��ȷ��
��������֪c�����⣩ƫ���ռ��ƫ��D��ȷ��
��ѡBCD��
�����㾫����������Ҫ����������к͵ζ������֪ʶ�㣬��Ҫ�����к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ������ȷ�����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ά����C��VitaminC����������Ѫ�ᣬ�������Ժ�ǿ��ԭ�ԣ�Ҳ��һ�ֳ�����ʳƷ���Ӽ�����ṹ��ͼ�������й�˵������ȷ���ǣ� �� 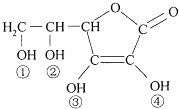
A.ά����C���ں���C�TO�����ܷ���������Ӧ
B.ά����C���ں���������������ˮ
C.ά����C�ķ���ʽΪC6H8O6
D.ά����C�����Կ����Ǣ١��������ǻ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ�����Ϳɳ����,����ͨ������,�õ���ܽϳ�ʱ�䱣���ȶ��ķŵ��ѹ��������ص��ܷ�ӦΪ3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH����ش���������:
3Zn(OH)2+2Fe(OH)3+4KOH����ش���������:
(1)������صĸ���������____��
(2)�ŵ�ʱ,��������____(���������ԭ��)��Ӧ;��֪������ӦΪZn-2e-+2OH-====Zn(OH)2,��������ӦΪ_______________________��
(3)�ŵ�ʱ,____(���������)��������Һ�ļ�����ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֡�����Ԫ�ؾ�λ�ڶ����ڣ�X��W��������֮��Ϊ23������˵����ȷ����
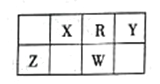
A. YԪ�ص�����������Ӧ��ˮ�����Ǻ�������������ǿ��
B. W��Rֻ���γ�һ�ֻ�����WR3����Ϊ����������
C. Z����̬�⻯���ȶ���ǿ��W����̬�⻯��
D. Z��R�γɵĻ�����ZR2������������Ʒ�Ļ���ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ���Ũ����ͬ��CH3COOH��NaOH��Һ��Ϻ���Һ��c��CH3COO����=c��Na+����������������������Һ������������=����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ�����Ȼ�������![]() ��
��![]() ��
��![]() �����ɵġ���֪��Ԫ�ص����ԭ��������35.5����11.7g�Ȼ����У���
�����ɵġ���֪��Ԫ�ص����ԭ��������35.5����11.7g�Ȼ����У���![]() ������Ϊ(����)
������Ϊ(����)
A. 1.75g B. 1.85g C. 5.25g D. 5.55g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������±��е���Ϣ�����ش����⣺
Ԫ�� | Ԫ�ػ���Ԫ����ɵ��������� |
A | ��������Ȼ����Ӳ�����ȼ�ղ�����������ʹ����ʯ��ˮ����ǡ� |
B | ԭ�������������Ǵ������������� |
C | ������ɫ��ӦΪ��ɫ��������ȼ�����ɵ���ɫ���� |
D | �����ڿ��������������� |
E | ����Ϊ����ɫ��ȼ�ղ���������Ư���ԡ� |
F | ��ͬ�����������ܶ���С |
��1���õ���ʽд���γ�F2E�Ĺ���__________________��
��2��д��CBF���ʵĵ���ʽ______________��
��3��C2B2�����д��ڻ�ѧ����������___________ ��1 molC2B2������AB2��Ӧת�Ƶĵ�����Ϊ_______��
��4����B��C��E�γɵļ����Ӱ뾶�ɴ�С�Ĺ�ϵ��______________�������ӷ��ű�ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ��ơ��������ơ�̼���ƺ�̼�������������г��������ʣ���ش��������⣮
��1����������̼���ƺ�̼���������������ᷴӦʱ����CO2������ǰ�����ߣ��������=����
��2��̼�����ƿ�����θ�ᣨ0.2%��0.4%�����ᣩ���࣬��Ӧ�����ӷ���ʽΪ ��
��3����ȥNaHCO3��Һ�е�����Na2CO3 �� �����ǣ� �� ���ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com