
| A、用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| B、物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
| C、除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大 |
| D、沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全 |


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
| | 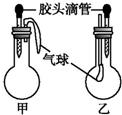 | 甲 | 乙 | |||
| A | 滴管中 | 烧瓶中 | 滴管中 | 烧瓶中 | ||
| B | ||||||
| 水 | 过氧化钠 | 饱和碳酸氢钠溶液 | CO2 | |||
| C | ||||||
| 水 | 钠 | 碳酸钠溶液 | CO2 | |||
| D | ||||||
| 水 | 氧化钠 | NaOH溶液 | CO2 | |||
| 稀盐酸 | 碳酸氢钠 | NaOH溶液 | CO | |||
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl |
| B、NaOH |
| C、Na2CO3 |
| D、干冰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
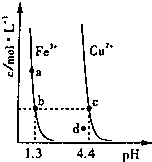 某温度下,Fe(OH)3(s)和Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图.线上任何一点表示的状态均为金属离子Mn+、OH-、M(OH)n(s)的平衡状态.据图分析,下列判断错误的是
某温度下,Fe(OH)3(s)和Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图.线上任何一点表示的状态均为金属离子Mn+、OH-、M(OH)n(s)的平衡状态.据图分析,下列判断错误的是| A、Ksp[Fe(OH)3]>Ksp[Cu(OH)2] |
| B、c、d两点代表的溶液中c(H+) 与c(OH-)乘积相等 |
| C、d点所代表的Cu(OH)2溶液达到了饱和 |
| D、向含有相同浓度Fe3+和Cu2+的混合溶液中逐滴滴加NaOH溶液,先形成Fe(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
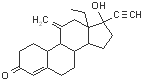
| A、依托孕烯的分子式为C21H28O2 |
| B、依托孕烯能与FeCl3溶液发生显色反应 |
| C、l mol依托孕烯最多能与5mol氢气发生加成反应 |
| D、依托孕烯能发生氧化、加成、消去、酯化等反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com