
 2SO3(g);△H=-197kJ/mol,由热化学方程式可知,在上述条件下反应生成1molSO3气体放热98.5kJ,加入2mol SO2和1molO2,生成的三氧化硫量小于2mol,所以a1<197,通入1mol SO2和0.5molO2,原则上讲会生成1mol三氧化硫,放热
2SO3(g);△H=-197kJ/mol,由热化学方程式可知,在上述条件下反应生成1molSO3气体放热98.5kJ,加入2mol SO2和1molO2,生成的三氧化硫量小于2mol,所以a1<197,通入1mol SO2和0.5molO2,原则上讲会生成1mol三氧化硫,放热| 1 |
| 2 |
| 1 |
| 2 |


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
(2013?洛阳二模)已知298K时下列物质的溶度积(单位略)
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | W | R | X | Y | Z | Q | M |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.110 | 0.160 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 | -3,+5 | +2 |
| ||
| ||
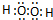
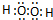
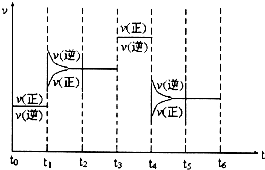
查看答案和解析>>
科目:高中化学 来源: 题型:
| SO | 2- 4 |
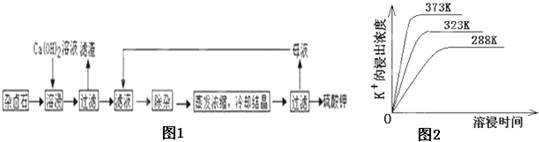
| CO | 2- 3 |
| SO | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| Cu2O |
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |

查看答案和解析>>
科目:高中化学 来源: 题型:
已知298K时反应2SO2( g ) + O2( g ) ![]() 2SO3( g );△H = -197 kJ · mol-1 ,在相同温度下向一密闭容器中加入2 mol SO2和1 molO2 ,达化学平衡时放出热量为a1 kJ ;向另一容积相同的密闭容器中通入 1 mol SO2和0.5 molO2 ,达化学平衡时放出热量为a2 kJ ,则下列关系式中正确的是( )
2SO3( g );△H = -197 kJ · mol-1 ,在相同温度下向一密闭容器中加入2 mol SO2和1 molO2 ,达化学平衡时放出热量为a1 kJ ;向另一容积相同的密闭容器中通入 1 mol SO2和0.5 molO2 ,达化学平衡时放出热量为a2 kJ ,则下列关系式中正确的是( )
A.2a2 <a1< 197
B.2a2 >a1 >197
C.2a2 = a1 >197
D.2a2 = a1 = 197
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com