
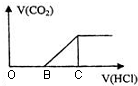
 向NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图.则下列分析正确的是(不计CO2溶解)( )
向NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图.则下列分析正确的是(不计CO2溶解)( )| A. | 若OB=0,则溶液M为Na2CO3溶液 | |
| B. | 若OB=BC,则形成溶液M所发生反应的离子方程式为OH-+CO2→HCO3- | |
| C. | 若溶液M中c(NaHCO3)=2c(Na2CO3),则3OB=BC | |
| D. | 若溶液M中大量存在的阴离子为CO32-和HCO3-,则OB>BC |
分析 CO2与NaOH反应为①CO2+NaOH=NaHCO3,②CO2+2NaOH=Na2CO3+H20,
当$\frac{n(C{O}_{2})}{n(NaOH)}$≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;
当$\frac{1}{2}$<$\frac{n(C{O}_{2})}{n(NaOH)}$<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
当$\frac{n(C{O}_{2})}{n(NaOH)}$≤$\frac{1}{2}$,反应按②进行,等于$\frac{1}{2}$时,CO2、NaOH恰好反应生成Na2CO3;小于$\frac{1}{2}$时,生成Na2CO3,NaOH有剩余;
向M中逐滴加入盐酸,根据溶液M中溶质不同,通过反应过程判断.
解答 解:(1)当含有两种溶质时,
①若溶质为Na2CO3、NaOH时,不能立即产生气体,滴加盐酸先中和氢氧化钠,然后与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积同碳酸氢钠与盐酸反应生成二氧化碳所消耗的盐酸体积相等,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为 ;
;
②若为NaHCO3、Na2CO3,不能立即产生气体,滴加盐酸先与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积小于与碳酸氢钠反应生成二氧化碳所消耗的盐酸体积,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为 ;
;
(2)若只有一种溶质时,
①当溶质为Na2CO3时,不能立即产生气体,滴加盐酸先与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积等于与碳酸氢钠反应生成二氧化碳所消耗的盐酸体积,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为 ;
;
②当溶质为NaHCO3时,滴加盐酸与碳酸氢钠反应生成二氧化碳,立即产生气体,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为 .
.
A.若OB=0,则形成溶液M所发生反应的离子方程式为OH-+CO2═HCO3-,则溶液M为NaHCO3溶液,故A错误;
B.若OB=BC,M溶质为Na2CO3,滴加盐酸先与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积等于与碳酸氢钠反应生成二氧化碳所消耗的盐酸体积,形成溶液M所发生反应的离子方程式为2OH-+CO2═CO32-+H2O,故B错误;
C.若3OB=BC,滴加盐酸先与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,则溶液M中c(NaHCO3)=2c(Na2CO3),故C正确;
D.若OB>BC,则溶液M中大量存在的阴离子为CO32-和OH-,故D错误;
故选C.
点评 本题考查混合物的有关计算,难度中等,关键判断溶液可能的溶质,分情况讨论.注意盐酸的体积.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
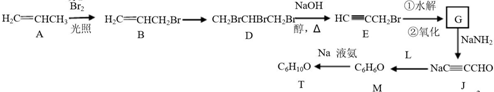
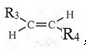 ,则T的结构简式为
,则T的结构简式为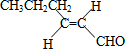 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 1mol•L-1NaHCO3溶液中含有HCO3-数目为NA | |
| B. | 1mol Cl2与足量的铁反应,转移的电子数为3NA | |
| C. | 标准状况下,22.4L乙醇的分子数为NA | |
| D. | 17g H2O2所含共价键的总数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:6 | B. | 2:15 | C. | 2:3 | D. | 16:25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g乙醇中含有共价键的数目为7NA | |
| B. | 50ml 2mol•L-1NaClO溶液中ClO-数目为0.1NA | |
| C. | 标准状况下,5.6gFe与足量的浓硫酸充分反应,转移电子数为0.2NA | |
| D. | 常温常压下,4.4g由CO2和N2O组成的混合气体所含原子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 方案一 | 方案二 |
| A | 除去木炭粉中的氧化铜 | 加足量稀盐酸,过滤 | 在空气中充分燃烧 |
| B | 分离NaCl和CaCO3的混合物 | 溶解,过滤,蒸发滤液 | 加足量稀盐酸,蒸发 |
| C | 检验稀盐酸和稀氢氧化钠溶液 | 分别测溶液的pH | 取样,加FeCl3溶液 |
| D | 鉴别化肥NH4Cl和NH4NO3 | 取样,加水溶解,观察 | 取样,加熟石灰研磨 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com