
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | -定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA | |
| C. | 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| D. | 4.6g乙醇含有共价键的数目为0.9NA |
分析 A.PH计算溶液中氢氧根离子浓度,结合体积和氢氧根离子浓度计算溶质物质的量分析;
B.反应为可逆反应不能进行彻底;
C.溶液中存在电荷守恒分析;
D.一个乙醇分子中含有共价键数目是8个共价键;
解答 解:A、pH=13的1.0LBa(OH)2溶液中,氢氧根离子浓度=$\frac{1{0}^{-14}}{1{0}^{-13}}$=0.1mol/L,所以含有的OH-数目=0.1mol/L×1L×NA=0.1NA,故A错误;
B.在密闭容器中2molSO2与2molO2充分反应达到化学平衡,最终的气体分子数大于3NA,故B错误;
C.将1molNH4NO3溶于稀氨水中使溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒,c(NH4+)+c(H+)=c(OH-)+c(NO3-),则溶液中n(NH4+)=n(NO3-)=1mol,NH4+数目为NA,故C正确;
D.4.6g的乙醇的物质的量为$\frac{4,6g}{46g/mol}$=0.1mol,含有共价键0.8mol,数目为0.8NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,熟练掌握公式的使用和物质的结构是解题的关键,注意可逆反应分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
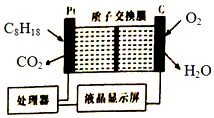
| A. | 石墨电极作正极,发生还原反应 | |
| B. | 铂电极的电极反应式:C8H18+16H2O-50e-═8CO2↑+50H+ | |
| C. | H+由质子交换膜左侧向右侧迁移 | |
| D. | 每消耗5.6LO2,电路中通过1 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不只是酸、碱、盐类物质才属于电解质 | |
| B. | 氯化钠溶液在电流作用下电离为钠离子与氯离子 | |
| C. | 电解质未必能导电,能导电的也未必是电解质 | |
| D. | 硫酸钡的水溶液虽导电性极弱,但硫酸钡是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
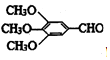 )和抗癫痫药物H(
)和抗癫痫药物H(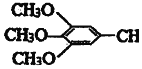 =CHCONHCH(CH3)2)的路线如图(部分反应略去条件和试剂):
=CHCONHCH(CH3)2)的路线如图(部分反应略去条件和试剂):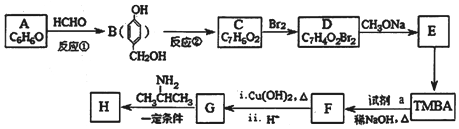
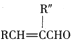 (R、R″表示烃基或氢)
(R、R″表示烃基或氢)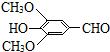 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O.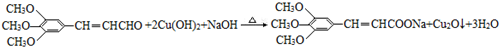 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cu2+、SO42-、Cl- | B. | Na+、H+、Cl-、CO32- | ||
| C. | H+、Ba2+、Cl-、NO3- | D. | K+、Fe2+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K +、.MnO 4 -、Cl -、SO 4 2- | B. | Na +、CO 3 2-、Cl -、SO 4 2- | ||
| C. | NO 3 -、Na +、HCO 3 -、Ba 2+ | D. | Na +、NO 3 -、NH 4 +、SO 4 2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀HNO3中加入铜粉产生气体:Cu+4H++2NO3-═Cu2++2NO2↑+H2O | |
| B. | 向H2SO4溶液中加入Ba(OH)2产生沉淀:SO42-+Ba2+═BaSO4↓ | |
| C. | 向Ca(ClO)2溶液中通入过量CO2制取HClO:2ClO-+H2O+CO2═HClO+CO32- | |
| D. | 向水中加入金属钠产生气体:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 95℃纯水的 pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液,稀释至 10 倍后 pH=4 | |
| C. | pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH>7 | |
| D. | pH 均为3的醋酸和盐酸分别与足量Zn反应,醋酸产生的H2多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com