
【题目】钛镍形状记忆合金(TiNi)被广泛用于人造卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式:_________,Ni在元素周期表中的位置是_________。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为______,中心原子的轨道杂化类型是_______。
(3)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是____________;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 _______________ 。
【答案】1s22s22p63s23d24s2或[Ar] 3d24s2 第4周期第VIII族 正四面体 sp3 产生白色沉淀 [Co (NH3)5SO4]Br
【解析】
(1)根据构造原理,由原子序数即可写出基态原子的电子排布式;
(2)根据价层电子数及中心原子进行判断;
(3)络合物由內界和外界组成,络合物溶于水发生电离生成內界离子(络离子)和外界离子,与BaCl2或AgNO3溶液反应的离子肯定为外界离子,由此可判断络合物的组成。
(1)基态Ti原子的电子排布式为1s22s22p63s23d24s2或[Ar] 3d24s2。Ni的原子序数为28,在元素周期表中的位置是第4周期第VIII族;
(2) SO42-的中心原子S的价层电子对数n=![]() =4,所以中心原子的轨道杂化类型是sp3,S原子与4个O原子形成4个σ键,所以SO42-立体构型为正四面体;
=4,所以中心原子的轨道杂化类型是sp3,S原子与4个O原子形成4个σ键,所以SO42-立体构型为正四面体;
(3)由[Co(NH3)5Br]SO4可知,硫酸根离子为配合物的外界,在水溶液中以离子形式存在,所以会与钡离子结合成白色沉淀。加入BaCl2溶液时,无明显现象,说明硫酸根离子在内界,若加入AgNO3溶液时,产生淡黄色沉淀,说明溴离子在外界,因此另一配合物的化学式为[Co (NH3)5SO4]Br。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物。请回答下列问题:
(1)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Mn属于___区。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti2+中电子占据的最高能层符号为___,该能层具有的原子轨道数为___,BH4-的空间构型是___。
(3)在Cu的催化作用下,乙醇可被空气中氧气氧化为乙醛,乙醛分子中碳原子的杂化方式是___,乙醛分子中HCO的键角___乙醇分子中H-C-O的键角(填“大于”、“等于”或“小于”)。
(4)电镀厂排放的废水中常含有剧毒的CN-,可在TiO2的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为___。
②与CN-互为等电子体微粒的化学式为___(写出一种即可)。
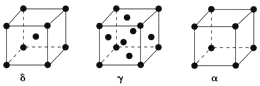
(5)单质铁有δ、γ、α三种同素异形体,三种晶胞中Fe原子的配位数之比为___,δ、γ、α三种晶胞的边长之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回收利用硫和氮的氧化物是环境保护的重要举措。
(1)已知:2NO(g ) + O2(g)![]() 2NO2(g),正反应的活化能为c kJmolˉ1。该反应历程为:
2NO2(g),正反应的活化能为c kJmolˉ1。该反应历程为:
第一步:2NO(g ) ![]() N2O2(g) △H1 =-a kJmolˉ1 (快反应)
N2O2(g) △H1 =-a kJmolˉ1 (快反应)
第二步:N2O2(g ) + O2(g)![]() 2NO2(g) △H2 =-b kJmolˉ1 (慢反应)
2NO2(g) △H2 =-b kJmolˉ1 (慢反应)
①下列对上述反应过程表述正确的是__________(填标号)。
A.NO比N2O2稳定
B.该化学反应的速率主要由第二步决定
C.N2O2为该反应的中间产物
D.在一定条件下N2O2的浓度为0时反应达到平衡
②该反应逆反应的活化能为_______________。
(2)通过下列反应可从燃煤烟气中回收硫。2CO(g) + 2SO2(g)![]() 2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:
2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:

①与实验a相比,实验b改变的实验条件可能是______________________。
②实验b中的平衡转化率a(SO2)=_________。
(3)用NH3消除NO污染的反应原理为: 4NH3 + 6NO![]() 5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:
5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:
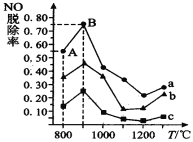
①曲线c对应NH3与NO 的物质的量之比是_______________。
②曲线a中 NO的起始浓度为4×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____________ mg/(m3s)。
(4)双碱法除去SO2是指:用 NaOH 吸收SO2,并用CaO使 NaOH再生。NaOH溶液 ![]() Na2SO3溶液
Na2SO3溶液
①用化学方程式表示NaOH 再生的原理____________________________________ 。
②25℃ 时,将一定量的SO2通入到NaOH溶液中,两者完全反应,得到含Na2SO3、 NaHSO3的混合溶液,且溶液恰好呈中性,则该混合溶液中各离子浓度由大到小的顺序为_____________(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L、体积不同的HA溶液与BOH 溶液混合,保持溶液的总体积为100 mL,溶液的体积与混合液pH 的关系如图所示。下列说法正确的是

A. V1表示HA 溶液的体积,V2表示BOH 溶液的体积
B. Ka( HA) 和Kb( BOH) 的数量级相等,均为10-6
C. y点时,c(B+)=c(A-)=c(OH-)=c(H+)
D. x、y、z 所示三点时水的电离程度:y>x=z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示,则下列说法不正确的是

A.两种酸溶液的物质的量浓度一定相等B.稀释后A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸D.若1<a<4,则A、B都是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的反应和实验装置如下:
SO2(g)+Cl2(g) ![]() SO2Cl2(l) ΔH=- 92.7 kJ/mol
SO2Cl2(l) ΔH=- 92.7 kJ/mol
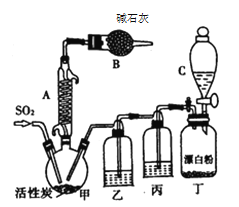
有关信息如下:硫酰氯通常条件下为无色液体,熔点为-54.1 ℃,沸点为69.1 ℃,密度为1.67g /cm3,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。回答下列问题:
(1)装置甲中仪器A的名称为___________,甲中活性炭的作用是________,B的作用为_________;
(2)装置丁中发生反应的离子方程式为__________________________;
(3)装置丙中的试剂为____________________,若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为_______________________________________;
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_______(填序号)。
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)本实验中通入SO2的体积为11.2 L(已折算成标准状况),Cl2充足,实验最终收集到硫酰氯27.0 mL,则硫酰氯的产率为_________________(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq)H3CuCl4(aq).
(1)实验室用如图1所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl﹣+2H2O═2CuCl43﹣+SO![]() +4H+
+4H+
CuCl43﹣(aq)CuCl(s)+3Cl﹣(aq)
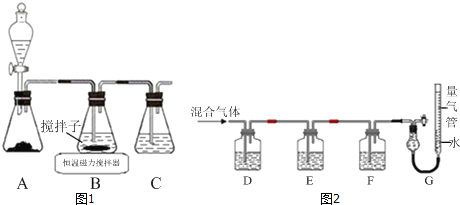
①装置C的作用是_____.
②装置B中反应结束后,取出混合物进行如图所示操作,得到CuCl晶体.
混合物![]()
![]()
![]()
![]()
![]() CuCl晶体
CuCl晶体
操作ⅱ的主要目的是_____
操作ⅳ中最好选用的试剂是_____.
③实验室保存新制CuCl晶体的方法是_____.
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案:_____.
(2)某同学利用如图2所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成.
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)ClH2O.
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气.
①D、F洗气瓶中宜盛放的试剂分别是_____、_____.
②写出保险粉和KOH的混合溶液吸收O2的离子方程式:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
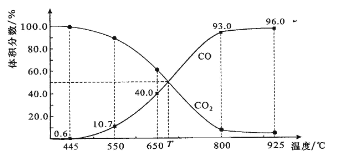
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com